题目内容
6.氧化镁在医药、建筑等行业应用广泛.硫酸镁(还原热解)制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3和不溶性杂质)为原料制备高纯氧化镁的实验流程如图: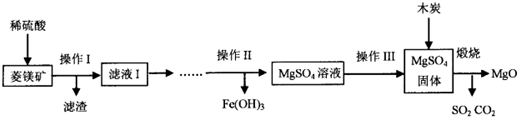
(1)MgCO3与稀硫酸反应的化学方程式是MgCO3+H2SO4=MgSO4+H2O+CO2↑基本类型是复分解反应.
(2)实验室中操作I玻璃棒的作用是引流,滤液I的成分(除硫酸外)是MgSO4、FeSO4.
(3)操作Ⅲ包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作.
(4)木炭和硫酸镁固体煅烧的反应方程式是2MgSO4+C$\frac{\underline{\;高温\;}}{\;}$2MgO+2SO2↑+CO2↑.
分析 (1)碳酸镁和稀硫酸反应生成硫酸镁、水和二氧化碳,碳酸亚铁和稀硫酸反应生成硫酸亚铁、水和二氧化碳;
(2)过滤时玻璃棒的作用是引流;
(3)通过蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作可以得到硫酸镁固体;
(4)高温条件下,硫酸镁和碳反应生成氧化镁、二氧化硫和二氧化碳.
解答 解:(1)MgCO3与稀硫酸反应的化学方程式是:MgCO3+H2SO4=MgSO4+H2O+CO2↑,属于复分解反应.
故填:MgCO3+H2SO4=MgSO4+H2O+CO2↑;复分解反应.
(2)实验室中操作I是过滤,玻璃棒的作用是引流,滤液I的成分(除硫酸外)是反应生成的MgSO4、FeSO4.
故填:引流;MgSO4、FeSO4.
(3)操作Ⅲ包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等一系列操作.
故填:蒸发浓缩.
(4)木炭和硫酸镁固体煅烧的反应方程式是:2MgSO4+C$\frac{\underline{\;高温\;}}{\;}$2MgO+2SO2↑+CO2↑.
故填:2MgSO4+C$\frac{\underline{\;高温\;}}{\;}$2MgO+2SO2↑+CO2↑.
点评 本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
18.难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
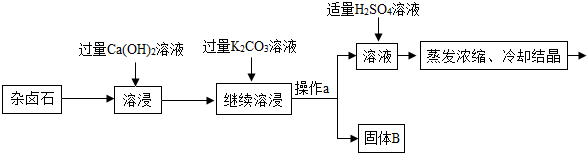
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的MgSO4;发生反应的化学方程式是MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数来表示浸取率,在相同的时间里,进行了如表实验组:
①上述实验的数据中,温度与K+浸取率的关系是温度越高,K+浸取率越高.
②如表5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.

(1)在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的MgSO4;发生反应的化学方程式是MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数来表示浸取率,在相同的时间里,进行了如表实验组:
| 实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
| a | 25 | 2.5 | 72.4 |
| b | 40 | 2.5 | 86.55 |
| c | 40 | 3 | 90.02 |
| d | 60 | 3 | 91.98 |
| e | 60 | 4 | 91.45 |
②如表5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.
15.要证明稀硫酸中含有盐酸所需药品正确的滴加顺序是( )
| A. | 先滴加AgNO3溶液再滴加BaCl2溶液 | |
| B. | 先滴加BaCl2 溶液再滴加AgNO3溶液 | |
| C. | 先滴加Ba(NO3)2 溶液再滴加AgNO3溶液 | |
| D. | 先滴加AgNO3 溶液再滴加Ba(NO3)2溶液 |
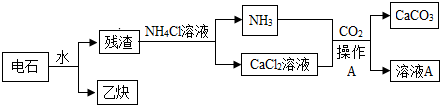
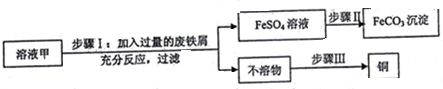
 A~N是初中学过的物质.D是相对分子质量为40的氧化物,A是不溶于稀硝酸的白色沉淀,E是难溶于水的白色沉淀.实验室通常用N制CO2,如图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.(注:难溶性碱加热分解生成对应的氧化物)
A~N是初中学过的物质.D是相对分子质量为40的氧化物,A是不溶于稀硝酸的白色沉淀,E是难溶于水的白色沉淀.实验室通常用N制CO2,如图是这些物质的转化关系,部分反应物、生成物及反应条件已省略.(注:难溶性碱加热分解生成对应的氧化物)
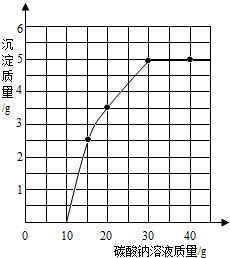 实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.