题目内容
20. 在探究课上,老师给同学们一包黑色粉末,该粉末是由铁粉和氧化铜粉末中的一种或两种组成,为了确定该粉末的成分,同学们进行如下探究,请回答下列问题:
在探究课上,老师给同学们一包黑色粉末,该粉末是由铁粉和氧化铜粉末中的一种或两种组成,为了确定该粉末的成分,同学们进行如下探究,请回答下列问题:【猜想假设】(1)黑色粉末是铁粉
(2)黑色粉末是氧化铜粉末
(3)黑色粉末是铁粉和氧化铜粉末
【设计方案】取少量黑色粉末,放入硬质玻璃管中,通入一氧化碳气体,片刻后加热充分反应(实验装置如图所示)
请填写下表空白:(不考虑铁粉和氧化铜粉末可能发生反应)
| 实验中可能出现的现象 | 结论 |
| 黑色粉末不变红,澄清的石灰水不变浑浊 | 猜想(1)成立 |
| 黑色粉末全部变红,澄清的石灰水变浑浊 | 猜想(2)成立(填成立或不成立) |
| 黑色粉末部分变红,澄清的石灰水变浑浊 | 猜想(3)成立 |
【反思评价】
(1)实验完毕后,先停止加热,继续通入一氧化碳直至玻璃管冷却至室温.继续通入一氧化碳的目的是防止生成的铜再次被氧化、澄清的石灰水倒吸入玻璃管中.
(2)从环保角度上看,上述设置有不足之处,改进措施是在b处放一只燃着的酒精灯(或安装尾气处理装置或在b处导管处绑一个小气球等).
(3)猜想(2)玻璃管中发生反应的化学方程式是CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
分析 【设计方案】根据一氧化碳和氧化铜可反应生成铜和二氧化碳,而一氧化碳和金属不发生反应,并结合实验现象和结论分析解答;
【反思评价】(1)据铜在温度较高的情况下可与氧气发生反应生成氧化铜进行回答;
(2)一氧化碳有毒,排放到空气中会造成大气污染,所以要在装置末端据一氧化碳的性质进行尾气处理或进行尾气收集;
(3)据一氧化碳与氧化铜反应原理书写方程式.
解答 解:【设计方案】一氧化碳和氧化铜可反应生成铜和二氧化碳,而一氧化碳和金属不发生反应;所以若猜想(1)成立,则黑色粉末不变红,澄清的石灰水不变浑浊;黑色粉末全部变红,澄清的石灰水变浑浊,说明一氧化碳与黑色粉末反应生成二氧化碳,黑色的氧化铜与一氧化碳反应生成红色的铜;若猜想(3)成立,则黑色粉末部分变红,澄清的石灰水变浑浊;
【反思评价】(1)铜在温度较高的情况下可与氧气发生反应生成氧化铜,所以为了防止生成的铜再次被氧化,以及石灰水倒吸引起玻璃管炸裂,要通一氧化碳至玻璃管冷却到室温;
(2)从环保角度上看,上述装置没有尾气处理装置,所以要在b处安装尾气处理装置,用气球收集起来或利用一氧化碳的可燃性将其燃烧掉;
(3)猜想(2)玻璃管中发生反应是一氧化碳和氧化铜在加热的条件下生成铜和二氧化碳,方程式是:CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2;
故答案为:
【设计方案】
| 实验中可能出现的现象 | 结论 |
| 黑色粉末不变红,澄清的石灰水不变浑浊 | 猜想(1)成立 |
| 黑色粉末全部变红,澄清的石灰水变浑浊 | 猜想(2)成立(填成立或不成立) |
| 黑色粉末部分变红,澄清的石灰水变浑浊 | 猜想(3)成立 |
(2)在b处放一只燃着的酒精灯(或安装尾气处理装置或在b处导管处绑一个小气球等);
(3)CO+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2.
点评 本题主要考查了一氧化碳的化学性质,了解一氧化碳的还原性、毒性、可燃性及一氧化碳还原氧化铜的注意事项才能依据题意正确分析和解答问题.

练习册系列答案
相关题目
3.正确观察和描述实验现象是学好化学的因素之一,下列说法中不正确的是( )
| A. | 镁条在空气中燃烧,发出耀眼的白烟 | |
| B. | 硫在氧气中燃烧,产生明亮的蓝紫色火焰 | |
| C. | 一氧化碳在空气中燃烧发出淡蓝色火焰 | |
| D. | 细铁丝在氧气中剧烈燃烧,火星四射,有黑色固体生成 |
8. 研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
【假设】H2O2 生成O2的快慢与催化剂种类有关
【实验方案】常温下,各取同质量、同浓度的H2O2 溶液,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】如图是他们进行实验的装置图,此实验中B处收集氧气的方法是排水法.
【实验记录】
【结论】比较数据你得出的结论是相同条件下H2O2生成O2的快慢与催化剂的种类有关.
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证MnO2和水泥块在化学反应前后的质量和化学性质是否发生改变.
分解H2O2 生成O2 的快慢与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响H2O2 生成O2 的快慢的因素以及相关假设和实验方案)
【假设】过氧化氢溶液的质量分数可能影响化学反应的速率.
【实验方案】同温下取2份质量相等,质量分数不同的H2O2溶液,分别加入质量相等的同种催化剂,测量收集一试管气体所需的时间.
 研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
研究性学习小组选择“H2O2 生成O2 的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:【假设】H2O2 生成O2的快慢与催化剂种类有关
【实验方案】常温下,各取同质量、同浓度的H2O2 溶液,分别加入相同质量的MnO2 和水泥块,测量各生成一瓶(相同体积)O2所需的时间.
【进行实验】如图是他们进行实验的装置图,此实验中B处收集氧气的方法是排水法.
【实验记录】
| 实验编号 | 1 | 2 |
| 反应物 | 5%H2O2 | 5%H2O2 |
| 催化剂 | 1g水泥块 | 1gMnO2 |
| 时间 | 165秒 | 46秒 |
【反思】H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证MnO2和水泥块在化学反应前后的质量和化学性质是否发生改变.
分解H2O2 生成O2 的快慢与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响H2O2 生成O2 的快慢的因素以及相关假设和实验方案)
【假设】过氧化氢溶液的质量分数可能影响化学反应的速率.
【实验方案】同温下取2份质量相等,质量分数不同的H2O2溶液,分别加入质量相等的同种催化剂,测量收集一试管气体所需的时间.
15. FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
【定性探究】分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,可通过观察产生气泡的快慢来定性比较两者的反应速率.
【定量探究】为进一步判断上述实验结论的准确性,小刚同学进行了如下实验方案设计.如图所示.
【方案一】在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
【方案二】在不同过氧化氢浓度下,测定相同时间收集气体体积的多少.
方案二的实验测量结果:
表中x=3,y=5.
实验结论:通过测量,若V1>V2(填“>”、“=”或“<”),说明在其他条件相同的情况下过氧化氢溶液浓度越大反应速率越快.
 FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.
FeCl3溶液对过氧化氢的分解起催化作用,某小组拟在相同浓度FeCl3溶液的催化下,探究过氧化氢浓度对过氧化氢分解速率的影响.【定性探究】分别取相同体积、不同浓度的过氧化氢溶液于锥形瓶中,注入相同体积、相同浓度的FeCl3溶液,可通过观察产生气泡的快慢来定性比较两者的反应速率.
【定量探究】为进一步判断上述实验结论的准确性,小刚同学进行了如下实验方案设计.如图所示.
【方案一】在不同过氧化氢浓度下,测定收集相同气体体积所需时间.
【方案二】在不同过氧化氢浓度下,测定相同时间收集气体体积的多少.
方案二的实验测量结果:
| 序号 | H2O2溶液的体积/mL | H2O2溶液的浓度/% | 2%FeCl3溶液的体积/mL | 反应的时间/min | 生成O2的体积m/L |
| 1 | 10 | 30 | x | 5 | V1 |
| 2 | 10 | 15 | 3 | y | V2 |
实验结论:通过测量,若V1>V2(填“>”、“=”或“<”),说明在其他条件相同的情况下过氧化氢溶液浓度越大反应速率越快.
5.已知2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3 被称为“铝热反应”.镁和氧化铜也能发生类似的反应,其化学方程式是Mg+CuO$\frac{\underline{\;高温\;}}{\;}$Cu+MgO.
某小组同学在实验室中进行镁和氧化铜反应的实验,充分反应后对于固体剩余物进行了实验探究.
【提出问题】固体剩余物是什么?
【猜想假设】假设①铜和氧化镁;假设②铜、氧化镁和氧化铜;假设③铜、氧化镁和镁.
【查阅资料一】大多数金属氧化物都能与盐酸反应生成金属氯化物和水(反应中元素化合价不发生改变).【实验探究】请完成下列实验.
【思考】是否任何一种金属单质都能与另一种金属氧化物反应?
【查阅资料二】该小组同学通过查阅资料,获得以下几组反应信息.
【总结】根据上表对比分析得出:金属单质与金属氧化物能发生反应,需满足的条件是金属单质的活动性比金属氧化物中所含金属的活动性强.
某小组同学在实验室中进行镁和氧化铜反应的实验,充分反应后对于固体剩余物进行了实验探究.
【提出问题】固体剩余物是什么?
【猜想假设】假设①铜和氧化镁;假设②铜、氧化镁和氧化铜;假设③铜、氧化镁和镁.
【查阅资料一】大多数金属氧化物都能与盐酸反应生成金属氯化物和水(反应中元素化合价不发生改变).【实验探究】请完成下列实验.
| 实验操作 | 实验现象 | 实验结论 |
| 取少量固体剩余物于试管中, 向其中加入足量的稀盐酸. | 固体部分溶解,溶液为无色. | 假设①成立. |
| 固体部分溶解,溶液为蓝色. | 假设②成立. | |
| 固体部分溶解,有气泡产生,溶液为无色. | 假设③成立. |
【查阅资料二】该小组同学通过查阅资料,获得以下几组反应信息.
| 实验组别 | I | II | III | IV | V |
| 药 品 | Al | Fe | Ag | Al | Cu |
| CuO | CuO | CuO | Fe2O3 | Fe2O3 | |
| 相同条件下是否反应 | 是 | 是 | 否 | 是 | 否 |
12.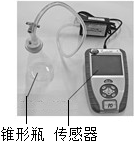 小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
(1)对二氧化锰在过氧化氢分解反应中的作用,下列分析正确的是B.
A.二氧化锰能使过氧化氢分解产生的氧气总质量增加
B.二氧化锰能使过氧化氢分解速度变大,但是产生氧气总质量不变
C.二氧化锰能使过氧化氢分解速度变大,产生的氧气总质量变大
(2)研究催化剂的某些因素对过氧化氢分解速率的影响
实验一:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).
测定数据如下表所示:
①加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,该步操作的实验目的是控制催化剂中金属离子的数量相同,对比它们种类对过氧化氢分解的速率影响.
②根据上表数据得出的结论是铁离子对过氧化氢的催化效果强于铜离子.
实验二:从一块土豆的同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,将两份土豆同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.观察到两量筒内均有气泡生成,一段时间后,只有土豆片不断上升,而土豆块不能上浮.通过实验得出的结论是反应物和催化剂的接触面积越大,反应速率越快.
 小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.
小明查阅资料得知,过氧化氢分解反应的催化剂除二氧化锰外,还有氯化铁溶液、氯化铜溶液中的金属离子和土豆中含有的过氧化氢酶等.他通过如下实验进行相关研究.(1)对二氧化锰在过氧化氢分解反应中的作用,下列分析正确的是B.
A.二氧化锰能使过氧化氢分解产生的氧气总质量增加
B.二氧化锰能使过氧化氢分解速度变大,但是产生氧气总质量不变
C.二氧化锰能使过氧化氢分解速度变大,产生的氧气总质量变大
(2)研究催化剂的某些因素对过氧化氢分解速率的影响
实验一:分别取20mL 5%的过氧化氢溶液于3个大小相同的锥形瓶中.向其中两个锥形瓶中分别加入含相同数目金属离子的氯化铁溶液和氯化铜溶液,分别连接传感器测体系压强(如图所示).
测定数据如下表所示:
| 时间/s 试剂 压强/KPa | 0 | 60 | 120 | 180 | 240 | 300 |
| 20mL 5%的过氧化氢溶液 | 101.86 | 102.99 | 103.42 | 103.67 | 103.99 | 104.00 |
| 加入氯化铁溶液 | 102.21 | 105.35 | 115.40 | 129.69 | 145.52 | 163.99 |
| 加入氯化铜溶液 | 101.50 | 102.73 | 107.53 | 114.78 | 122.49 | 130.39 |
②根据上表数据得出的结论是铁离子对过氧化氢的催化效果强于铜离子.
实验二:从一块土豆的同一部位取2个质量均为1.7g的正方体土豆块,将其中一块切成若干片,片与片相连不断开,将两份土豆同时分别放入盛30mL 5%过氧化氢溶液的50mL量筒中.观察到两量筒内均有气泡生成,一段时间后,只有土豆片不断上升,而土豆块不能上浮.通过实验得出的结论是反应物和催化剂的接触面积越大,反应速率越快.
9.下列说法正确的是( )
| A. | 同种溶质的饱和溶液一定比不饱和溶液浓度大 | |
| B. | 硝酸钾在20℃时溶解度是31.6 g,则20℃吋100 g硝酸钾饱和溶液中含有硝酸钾31.6 g | |
| C. | 汽油能除去油污,是因为汽油具有乳化作用. | |
| D. | 溶液析出晶体后,溶液的溶质质量分数可能不变 |
