题目内容
13. 向100g硫酸铜溶液中,逐滴加入NaOH溶液,化学反应方程式为:
向100g硫酸铜溶液中,逐滴加入NaOH溶液,化学反应方程式为:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
加入NaOH溶液的质量与生成沉淀的质量之间的关系如图所示,请回答下列问题:
(1)Cu(OH)2质量为9.8g;
(2)计算硫酸铜溶液溶质质量分数(请写出计算过程).
分析 (1)根据图象分析氢氧化铜的质量;
(2)根据方程式结合氢氧化铜沉淀的质量9.8g,可以计算硫酸铜的质量,进一步计算硫酸铜溶液溶质质量分数
解答 解:(1)由图象可见氢氧化铜沉淀的质量为9.8g;故填:9.8;
(2)设硫酸铜溶液中溶质质量为x,
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 98
x 9.8g
$\frac{160}{x}=\frac{98}{9.8g}$
x=16g
硫酸铜溶液溶质质量分数为$\frac{16g}{100g}$×100%=16%.
答:硫酸铜溶液溶质质量分数为16%.
点评 本题主要考查学生根据化学方程式找出已知量和未知量的关系列比例式求解问题的能力及溶质质量分数的计算问题.

练习册系列答案
 核心素养学练评系列答案
核心素养学练评系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目
3.掌握科学的研究方法,探索化学世界的奥秘.
(1)分类是学习化学的重要方法之一.
①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同)D,属于氧化物的是C.
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是B.
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO3在MnO2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO2难溶于水)

①图A中试管口略向下倾斜的原因是防止水倒流,炸裂试管,图B操作中玻璃棒的作用是搅拌,加速溶解.
②图C操作中的一处明显错误是漏斗末端没有紧靠烧杯内壁,图D操作中,当看到有较多固体析出时,停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.
①下列表述正确的是B
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O2完全反应后,生成64g SO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如下表:
则x=88,已知参加反应的物质R与氧气的分子个数之比为1:3,则R的相对分子质量是46.
(1)分类是学习化学的重要方法之一.
①生活中,常会接触到下列物质:
A.铜丝 B.甲烷 C.过氧化氢 D.碘酒
其中属于混合物的是(填字母,下同)D,属于氧化物的是C.
②根据物质在转化过程中的特点,可将化学反应分为化合反应,分解反应、置换反应和复分解反应四种基本反应类型,下列转化不属于这四种基本反应类型的是B.
A.生石灰与水反应 B.一氧化碳还原氧化铁 C.中和反应
(2)实验是学习化学的一条重要途径,实验室中可用KClO3在MnO2催化下受热分解制取氧气,并将反应后的混合物进行分离回收,实验操作如图所示(MnO2难溶于水)

①图A中试管口略向下倾斜的原因是防止水倒流,炸裂试管,图B操作中玻璃棒的作用是搅拌,加速溶解.
②图C操作中的一处明显错误是漏斗末端没有紧靠烧杯内壁,图D操作中,当看到有较多固体析出时,停止加热.
(3)质量守恒定律是帮助我们学习的认识化学反应实质的重要理论.
①下列表述正确的是B
A.蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律
B.每32g S和32g O2完全反应后,生成64g SO2
C.在化学反应aA+bB=cC+dD中一定有:a+b=c+d
②有机化合物R与足量氧气置于密闭容器中充分反应生成CO2和H2O,实验测得反应前后物质的质量如下表:
| R | O2 | CO2 | H2O | |
| 反应前质量/g | 46 | 128 | 0 | 0 |
| 反应后质量/g | 0 | 32 | x | 54 |
4.下列生活中的变化过程只发生物理变化的是( )
| A. | 从铝土矿中提取金属铝 | |
| B. | 秸秆、杂草、粪便等在沼气池中发酵制得甲烷 | |
| C. | 二氧化碳气体经降温、加压制得干冰 | |
| D. | 排放到空气中的二氧化硫形成酸雨 |
1.2016年3月联合国秘书长潘基文任命游戏“愤怒的小鸟”为绿色荣誉大使,以鼓励年轻人应对气候变化及环境污染采取积极的行动.以下哪些行为是不提倡的( )
| A. | 出行多选择自行车和公交车 | B. | 大量使用塑料袋方便购物 | ||
| C. | 植树造林,增加城市绿地面积 | D. | 对垃圾分类,回收利用 |
8.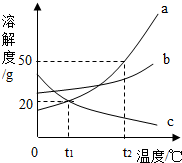 如图是三种物质的溶解度曲线,下列说法正确的是( )
如图是三种物质的溶解度曲线,下列说法正确的是( )
 如图是三种物质的溶解度曲线,下列说法正确的是( )
如图是三种物质的溶解度曲线,下列说法正确的是( )| A. | 物质c的溶解度随温度的升高而增大 | |
| B. | 物质a的溶解度大于物质c的溶解度 | |
| C. | t2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160g | |
| D. | 将t1℃b、c两种物质的饱和溶液升温至t2℃,溶液中溶质质量分数不变的是b溶液 |
18.分类、归纳是学习化学知识的重要手段,下列物质的分类不正确的是( )
| A. | 硫-单质 | B. | 纯碱-碱 | C. | 酒精-有机化合物 | D. | 生石灰-氧化物 |
5. 如图是镁元素在元素周期表的信息和原子结构示意图,下列判断不正确的是( )
如图是镁元素在元素周期表的信息和原子结构示意图,下列判断不正确的是( )
 如图是镁元素在元素周期表的信息和原子结构示意图,下列判断不正确的是( )
如图是镁元素在元素周期表的信息和原子结构示意图,下列判断不正确的是( )| A. | 一个镁原子的质量是24.31g | |
| B. | 镁原子有12个质子 | |
| C. | 镁原子在化学反应中易失去2个电子 | |
| D. | 镁元素在化合物中显正价 |
2.分类是学习化学的方法之一,下列物质按混合物,碱,氧化物的顺序排列的是( )
| A. | 空气、氢氧化钠、水 | B. | 液氧、纯碱、空气 | ||
| C. | 生铁、石油、干冰 | D. | 矿泉水、熟石灰、高锰酸钾 |
