题目内容
实验后的废液一般需回收处理,不能直接倒入排污管。小科实验后收集到含有碳酸钠和氧氧化钠的混合废液10.22g,他向废液中缓缓滴入溶质质量分数为19.6%的稀硫酸,生成二氧化碳质量与滴入稀硫酸质量的关系如图所示。当废液恰好处理完毕时,溶液总质量为20g。溶于水的气体忽略不计,则

(1)废液恰好处理完毕时,溶液的pH为 。
(2)图中m= g。
(3)废液恰好处理完毕时,回收所得溶液的溶质质量分数是多少?
【答案】(1)7;(2)10;(3)14.2%
【解析】废液恰好处理完毕时,溶液为硫酸钠溶液,其PH=7;此时共产生二氧化碳的质量为0.22g,二氧化碳的质量与反应后溶液总质量的和等于混合溶液与加入稀硫酸的质量和,由此可求得加入稀硫酸的质量=20g+0.22g-10.22g=10g。
该反应过程中,硫酸分别与氢氧化钠和碳酸钠反应生成硫酸钠,根据硫元素守恒可列关系式,由硫酸的质量计算硫酸钠的质量,从而求得反应后溶液中溶质的质量分数。
设反应后生成硫酸钠的质量为x, 则:
则:
H2SO4 ~ Na2SO4
98 142
10g×19.6% x
98/142=10g×19.6%/ x
解得x=2.84g
则反应后溶液中溶质的质量分数=2.84g /20g×100%=14.2%
答:废液处理完毕时,所得溶液的溶质质量分数是14.2%

某兴趣小组发现一袋腌制松花蛋的泥料,配料表上的成分是氧化钙、纯碱和食盐。他们要探究在腌制松花蛋过程中都有哪些物质对鸭蛋起作用。于是取少量泥料在水中溶解,充分搅拌后过滤,取滤液探究其成分。
【猜想与假设】他们都认为滤液中一定有NaCl和NaOH。生成氢氧化钠的化学方程式为:________________________________。对其他成分他们分别做出了如下猜想:
小亮猜想:还可能有Na2CO3。
小强猜想:还可能有Ca(OH)2和Na2CO3。
你认为__________的猜想是错误的,理由是______________________________。
你还能做出的猜想是:还可能有________________。
【活动与探究】小亮取一定量的滤液于试管中,向其中滴加了几滴稀盐酸,振荡,没有气泡,于是他得出结论:滤液中没有Na2CO3。
请你选择CO2以外的物质,设计一个实验方案验证你的猜想。
| 实验步骤 | 现象及相应结论 |
【反 思】小强认为小亮的结论不严密,理由是______________________________。
临近中考,家长为了给学生增加营养,制定了如下食谱:
| 主食 | 馒头、米饭 |
| 副食 | 红烧牛肉、清蒸西江鱼 |
| 饮料 | 酸牛奶、白开水 |
用你所学的知识,建议家长增加的食物是( )
A.炒鸡蛋 B.蒸猪排骨
C.炖豆腐 D.炒瓜苗
将4.0g Cu—Zn合金粉末放到盛有10g稀硫酸的烧杯中,恰好完全反应。过滤,称量滤液的质量,相关实验数据如下:
| 反应前物质质量/g | 反应后物质质量/g | |
| Cu—Zn合金 | 稀硫酸 | 滤液质量 |
| 4.0 | 10 | 11.26 |
⑴Cu—Zn合金属于 材料(填“金属”或“有机合成”)。
⑵若不考虑该合金中除Cu、Zn以外的其它成分,请计算原Cu—Zn合金中Zn的质量。写出必要的计算过程。(Zn-65 Cu-63.5 H-1 O-16 S-32)



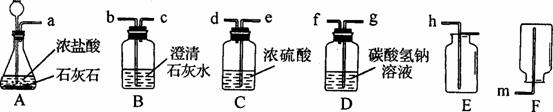 ①A中反应的化学方程式为___________________________________________________。
①A中反应的化学方程式为___________________________________________________。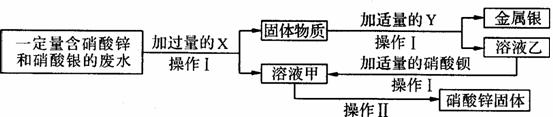 ①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。
①X为____;乙与硝酸钡反应的化学方程式为_____________________________________。