题目内容
9.有一包固体粉末,可能由NaOH、Na2SO4、MgCl2、CuSO4中的一种或几种组成.为了分析固体粉末的成分,某实验小组同学取少量该粉末进行实验,实验方案设计如下:
(1)若现象X为“沉淀不溶解”或“沉淀部分溶解”,结论是固体粉末由NaOH、MgCl2、Na2SO4组成;若现象X为“沉淀全部溶解”,结论是固体粉末没有Na2SO4;
(2)写出实验步骤②的化学方程式Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;
(3)简单修改上述实验方案,可取消第④步实验,修改的方法是将氢氧化钡溶液换成氯化钡或者硝酸钡溶液.
分析 本题是混合物成分的推断,由于限定的是四种物质,而其中的硫酸铜溶解于水有明显的蓝色或者反应也显示蓝色,而给定的现象中无颜色的提示,说明无硫酸铜.剩余物质之间氢氧化钠和氯化镁能够反应生成白色沉淀,根据题目的叙述可以看出一定存在这两种物质,而加入硝酸白色沉淀全部溶解也进一步证明了真的是存在能够和硝酸反应的氢氧化镁白色沉淀.而无色溶液此时可能是硫酸钠和氢氧化钠或者是氯化镁与硫酸钠,只有这两种可能性,加入氢氧化钡,生成白色沉淀,这个沉淀可能与加入钡离子有关,则原物质中含有硫酸钠;若是与镁离子有关,同样也会生成白色沉淀.而现象为“沉淀不溶解”或“沉淀部分溶解”,都是说明有硫酸钡的生成,所以原物质中有硫酸钠.
若要取消第④部,也就是验证是否真的是硫酸钡,只需要排除氢氧化镁可能的干扰,这样只需要在加入试剂时不引入氢氧根离子即可,所以将氢氧化钡换成可溶性钡盐,如氯化钡或者硝酸钡即可.
解答 解:由于限定的是四种物质,是NaOH、Na2SO4、MgCl2、CuSO4中的一种或几种组成.
(1)其中的硫酸铜溶解于水有明显的蓝色或者反应也显示蓝色,而给定的现象中无颜色的提示,说明无硫酸铜.剩余物质之间氢氧化钠和氯化镁能够反应生成白色沉淀,根据题目的叙述可以看出一定存在这两种物质,而加入硝酸白色沉淀全部溶解也进一步证明了真的是存在能够和硝酸反应的氢氧化镁白色沉淀.而无色溶液此时可能是硫酸钠和氢氧化钠或者是氯化镁与硫酸钠,只有这两种可能性,加入氢氧化钡,生成白色沉淀,这个沉淀可能与加入钡离子有关,则原物质中含有硫酸钠;若是与镁离子有关,同样也会生成白色沉淀.而现象为“沉淀不溶解”或“沉淀部分溶解”,由于氢氧化镁能够和硝酸反应而溶解,这就说明有硫酸钡的生成,所以原物质中有硫酸钠.故若现象X为“沉淀不溶解”或“沉淀部分溶解”,结论是固体粉末由NaOH、MgCl2、Na2SO4组成;若现象X为“沉淀全部溶解”,结论是固体粉末没有Na2SO4;
(2)通过推导可知,粉末中含有的氢氧化钠能与氯化镁反应生成白色的氢氧化镁沉淀,氢氧化镁沉淀能与硝酸反应生成硝酸镁和水,化学方程式为:Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;
(3)若要取消第④部,也就是验证是否真的是硫酸钡,只需要排除氢氧化镁可能的干扰,这样只需要在加入试剂时不引入氢氧根离子即可,所以将氢氧化钡换成可溶性钡盐,如氯化钡或者硝酸钡即可.
故答案为:
(1)NaOH、MgCl2、Na2SO4;没有Na2SO4;
(2)Mg(OH)2+2HNO3=Mg(NO3)2+2H2O;
(3)将氢氧化钡溶液换成氯化钡或者硝酸钡溶液.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后结合题中的现象分析各种物质的存在性,最后确定混合物的成分,注意选取的试剂不能对后续检验造成干扰.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| 实验方案 反应现象 | 方案一(A图) (1)产生大量白烟 | 方案一(B图) 产生大量的气泡 | 方案一(C图) (2)铁钉表面覆盖一层红色物质,溶液由蓝色变成浅绿色 |
| 反应前的总质量 | m1 | W1 | n1 |
| 反应后的总质量 实验结论分析 | m2 (3)A同学实验:白磷刚引燃,立即将锥形瓶放到天平上称量,天平不平衡.结论:质量不守恒.你认为该结论是否正确不正确 | w2 (4)w1>w2 | n2 n1=n2 |
(6)写出方案三(C)中化学方程式Fe+CuSO4=FeSO4+Cu;
(7)A同学实验结论是天平不平衡(游码在零处)的原因可能是①③(选择序号).
①没有塞好塞子,有白烟冒出;②物体和密码放反了;③白磷刚引燃,立即将锥形瓶放到天平上称量,致使气球膨胀产生空气浮力.
| A. | KNO3 | B. | Ca3(PO4)2 | C. | NH4Cl | D. | K2CO3 |
 铟具有光渗透性和强导电性,广泛用于生产液晶显示器.元素周期表中“铟”的信息如图所示.下列关于铟元素说法,错误的是( )
铟具有光渗透性和强导电性,广泛用于生产液晶显示器.元素周期表中“铟”的信息如图所示.下列关于铟元素说法,错误的是( )| A. | 是非金属元素 | B. | 元素符号为Ir | ||
| C. | 相对原子质量为114.82 | D. | 原子序数为49 |


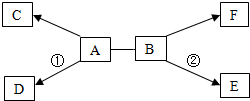 A-F是初中化学常见的六种物质,已知A广泛用于造纸、玻璃、洗涤剂生产等工业,C和F都是无色气体,且F是单质,反应①和②都有白色沉淀生成.它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两种物质能相互反应;部分反应物、生成物及反应条件未标出).请回答下列问题:
A-F是初中化学常见的六种物质,已知A广泛用于造纸、玻璃、洗涤剂生产等工业,C和F都是无色气体,且F是单质,反应①和②都有白色沉淀生成.它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两种物质能相互反应;部分反应物、生成物及反应条件未标出).请回答下列问题: