题目内容
化学兴趣小组设计的创新实验是“火龙生字”。在成果展示现场,某同学用硝酸钾的热饱和溶液先在白纸上书写“火”字,晾干后白纸上出现硝酸钾晶体(见图1)。用带火星的木条接触硝酸钾晶体,就会观察到白纸上写过字的地方燃烧并迅速蔓延,留下“火”字的黑色痕迹(间图2)。在场的同学对此产生了浓厚的兴趣,并进行了如下探究:
【提出问题】为甚附有硝酸钾的白纸更容易燃烧?
【查阅资料】硝酸钾受热易分解,生成亚硝酸钾(KNO2)和一种常见的气体单质。
【猜想与假设】对于生成的是什么气体,四位同学有如下猜想:

甲:二氧化氮;乙:氮气;丙:氧气;丁:氢气。
同学丙指出不可能是二氧化氮、氢气,理由是: ; 。
【进行实验】四位同学设计了实验对同学丙的猜想进行了验证,他们的操作方法是:
,观察到的现象是 ,说明同学丙的猜想正确。
硝酸钾分解的化学方程式是 :
【解释与结论】白纸上写过字的地方更容易燃烧的原因是: 。
【反思与评价】为什么要用“硝酸钾的热饱和溶液”书写文字?
已知硝酸钾在不同温度时的溶解度如下表:
| 温度/℃ | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 31.6 | 63.9 | 110 | 169 | 246 |
你对上述问题的解释: 。
【答案】【猜想与假设】二氧化氮不是单质 硝酸钾中不含氢元素
【进行实验】将少量硝酸钾晶体放入试管中加热,把带火星的木条伸入试管中 带火星的
△
木条复燃 2KNO3=====2KNO2+O2↑
【解释与结论】硝酸钾晶体受热生成氧气,使得写过字的白纸附近氧气浓度增加
【反思与评价】硝酸钾的溶解度随温度的升高而增大,用热热饱和溶液能使白纸附着较多的硝酸钾
【解析】【猜想与假设】审题:因硝酸钾受热易分解,生成亚硝酸钾(KNO2)和一种常见的气体单质。故不可能生成二氧化氮,另根据化学反应前后元素种类不变,反应物硝酸钾中不含氢元素,所以气体单质不可能是氢气;【进行实验】根据结论丙同学猜想正确,说明生成了氧气,故操作就是如何检验氧气。方程式书写注意配平即可;【解释与结论】审题:要注意“更容易燃烧”,根据使物质充分燃烧条件一是可以增大可燃物与氧气的接触面积,而是要有足够多的氧气,此处纸张与空气的接触面积不变,很显然更容易燃烧是因为氧气增多了,主要是因为硝酸钾分解能产生氧气,可以使写过字的白纸附近氧气浓度增加;【反思与评价】硝酸钾的溶解度随温度的升高而增大,用热热饱和溶液能使白纸附着较多的硝酸钾

 名校课堂系列答案
名校课堂系列答案实验室可利用碱式碳酸铜(化学式:Cu2(OH)2CO3)制备氧化铜,并进行碳粉还原氧化铜的实验。
①制备氧化铜并检验产物,装置如下图所示(省略夹持仪器):

步骤一:连接A和B,打开活塞,通入空气。
步骤二:关闭活塞,连上C和D,开始加热。
步骤三:在加热过程中,记录在B中固体质量变化如下表,在t3时停止加热。
| 加热时间(min) | 0 | t1 | t2 | t3 |
| B中固体质量(g) | 6.66 | 5.20 | 4.80 | 4.80 |
B中发生反应的化学方程式为: 1 Cu2(OH)2CO3 2CuO + 1 H2O + 1 CO2↑
2CuO + 1 H2O + 1 CO2↑
 请在 中填入配平后的系数 。
请在 中填入配平后的系数 。
C中试剂是 。A的作用是吸收空气中的 ,防止对产物检验造成干扰。选择t3时停止加热的理由是 。
② 一定量碳粉还原①中制得的氧化铜并检验产物,装置如下图所示:

实验过程中,观察到F中溶液变浑浊,E中的现象是 。
反应完全后,若仅撤走酒精喷灯停止加热,可能导致的后果是 。
③ 分析:若①中省略步骤三,对②中反应产物判断可能产生的影响及其原因。
同学们在帮助老师整理实验室时,从1、2号橱窗中发现了两瓶失去标签的黑色粉末药品,并确定了这两瓶黑色粉末是木炭粉、铁粉、氧化铜、高锰酸钾中的两种。
他们继续进行了分析、试验和反思:
【查阅资料】 CuO、Fe2O3等金属氧化物与酸反应,生成盐和水
⑴ 分析:小燕同学认为一定不是高锰酸钾,原因是 ;
⑵ 实验一:
| 实验操作 | ||
| ①取一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末溶解,溶液颜色变__ _ | 此粉末是氧化铜 |
| ②取另一种黑色粉末少许,加入到稀硫酸中 | 黑色粉末不溶解,没看到气体产生 | 此粉末一定不是铁粉 |
⑶ 反思:小华同学认为不做实验①,运用逻辑推理的方法也能得出其中之一是氧化铜的结论,原因是:_______________________________________________________________;
⑷ 实验二:他们又进行了如下实验:将两种黑色粉末混合加热(实验装置如下图),发现黑色粉末逐渐变_____,澄清石灰水变______。写出两种黑色粉末发生反应的化学方程式__ ___ _。

某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验,向烧杯中的氢氧化钙溶液滴加一定量的稀盐酸后,发现忘记滴加指示剂,此时,他们停止滴加稀盐酸,并对烧杯内溶液中溶质的成分进行探究。
(1)写出该中和反应的化学方程式_______________________。
(2)探究烧杯内溶液中溶质的成分:
【作出猜想】
(A)溶质可能是CaCl2与Ca(OH)2
(B)溶质可能是CaCl2
(C)溶质可能是CaCl2与HCl
【查阅资料】CaCl2溶液呈中性
【实验设计】
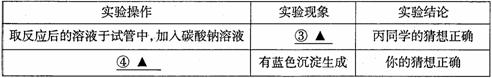
①取少量烧杯中的溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是排除了猜想(A),你认为排除猜想(A)的理由是_____________。
②小华想用碳酸钠溶液来验证后两种猜想,请你帮他完成实验,填写以下表格:
| 实验步骤 | 预计现象 | 预计结论 |
| 取少量反应后的溶液于试管中, 逐滴加入碳酸钠溶液 | 猜想(B)正确 | |
| 猜想(C)正确 |
【交流反思】
为确定猜想(C)正确,下列几种实验方案不合理的是__________(填字母)。
A.取反应后的溶液于试管中,滴加紫色石蕊试液变红色
B.取反应后的溶液于试管中,加入锌粉冒气泡
C.用洁净的玻璃棒蘸取反应后的溶液,涂抹在pH试纸上,测溶液的pH <7
D.取反应后的溶液于试管中,加入硝酸银溶液,生成白色沉淀

 想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用氢气还原氧化铜所得红色固体Cu中是否含有Cu2O(红色),进行了认真的探究。请你一起踏上探究之路,回答下列问题。
想,也是研究物质组成的重要方法。某研究性学习小组为检测实验室用氢气还原氧化铜所得红色固体Cu中是否含有Cu2O(红色),进行了认真的探究。请你一起踏上探究之路,回答下列问题。
 【查阅资料】(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。(2)氯化钙、氯化钡溶液均呈中性。
【查阅资料】(1)该固体酒精是用酒精、氯化钙和氢氧化钠按一定的质量比混合制成。(2)氯化钙、氯化钡溶液均呈中性。