题目内容
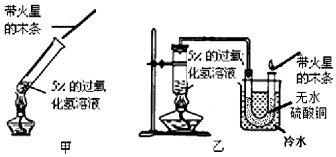
15. 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )| A. | 水、一氧化碳气体 | B. | 硫酸、氮气 | ||
| C. | 硝酸银溶液、氯化钡粉末 | D. | 氢氧化钾溶液、二氧化碳气体 |
分析 根据已有的知识进行分析,水的沸点随压强的降低而降低,95℃的水沸腾了,说明压强变小了,则②中气体B与液体A发生了化学反应,据此解答.
解答 解:A、一氧化碳很难溶于水,压强不会变化,故A错误;
B、硫酸与氮气不反应,压强不变,故B错误;
C、硝酸银溶液、氯化钡粉末生成氯化银沉淀和硝酸钡,试管内气体压强不会发生变化,故C错误;
D、氢氧化钾溶液能与二氧化碳反应生成碳酸钾和水,二氧化碳气体被消耗,导致压强变小,①中水可以沸腾,故D正确;
故选D.
点评 本题考查了物质间的反应以及与物理压强知识的结合,完成此题,可以依据物质的性质进行.要求同学们加强对物质性质以及物质间反应实验现象的掌握,以便灵活应用.

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目
6.四只烧杯中分别盛有稀盐酸,并滴加了数滴石蕊试液.现向这四只烧杯中不断加入下列物质,直至过量,其中能使溶液最后呈紫色的物质是( )
| A. | Na2SO4 | B. | Zn (OH)2 | C. | Na2O | D. | KOH |
7.西湖龙井茶全国有名,为保持茶叶的品质,要做到防潮和防氧化.为此在茶叶的包装袋内往往放入一小包黑色的“双吸剂”.下列可作为“双吸剂”的 是( )
| A. | 碳粉 | B. | 碱石灰 | C. | 铁粉 | D. | 二氧化锰 |
4.实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如图所示几个实验.得知:Na2CO3溶液和澄清石灰水都呈碱性(pH>7),CaCl2溶液呈中性(pH=7).
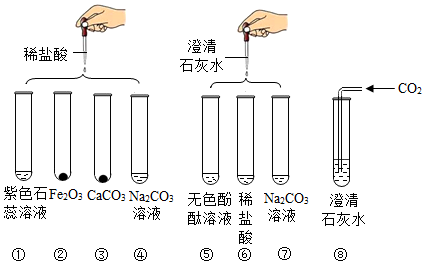
(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)实验后某试管中为红色溶液,向其中加入足量的稀盐酸,溶液变为无色.由此推断,该试管中最初盛有的物质是无色酚酞试液.
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现.由此推断,该试管中最初发生反应的化学方程为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)实验某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.由此推断,该试管中最初发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,其反应类型为复分解反应.
(5)实验结束后,某同学将⑤⑥⑦三个试管的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,由此分析可知:
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有氢氧化钠.
②依据上述实验过程,你认为引起废液呈碱性的物质组成共有3种可能.
③为了进一步探究废液的成分,该同学进行以下实验:

(1)实验后某试管中为黄色溶液,该试管中发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(2)实验后某试管中为红色溶液,向其中加入足量的稀盐酸,溶液变为无色.由此推断,该试管中最初盛有的物质是无色酚酞试液.
(3)实验后某试管的底部有白色固体,过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现.由此推断,该试管中最初发生反应的化学方程为Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.
(4)实验某试管中只得到无色溶液,向其中加入足量的Na2CO3溶液,无明显现象.由此推断,该试管中最初发生反应的化学方程式为Na2CO3+2HCl=2NaCl+H2O+CO2↑,其反应类型为复分解反应.
(5)实验结束后,某同学将⑤⑥⑦三个试管的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,由此分析可知:
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有氢氧化钠.
②依据上述实验过程,你认为引起废液呈碱性的物质组成共有3种可能.
③为了进一步探究废液的成分,该同学进行以下实验:
| 步骤 | 操作 | 现象 | 结论 |
| 第一步 | 取样,加入少量盐酸 | 无气泡产生 | 废液中一定没有碳酸钠 |
| 第二步 | 再次取样,进行实验⑧ | 无白色沉淀产生 | 废液中只有氢氧化钠 |
5.小敏利用氢气还原氧化铜的原理和下图装置及药品进行实验(操作规范)来测定水的组成.(假设生成的水完全被丁中碱石灰吸收,装置内空气中的水蒸气、CO2忽略不计).下列说法错误的是( )


| A. | 洗气瓶乙中浓硫酸的作用是干燥氢气 | |
| B. | 丙装置中的氧化铜没有完全被还原,会影响实验结果 | |
| C. | 实验中,通过测定丙、丁装置质量的改变值,就能达到测定水的组成的目的 | |
| D. | 该装置存在缺陷,应该在丁装置后再连接一个盛碱石灰的干燥管 |
 “空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
“空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题: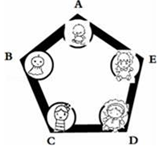 兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)
兴趣小组把A、B、C、D、E围成如图所示的“化学游乐城”,已知盐酸、硫酸、氢氧化钠、氯化钡和碳酸钠是五种物质的选项,游娱规则为只有相邻物质间能发生反应才能组成守护防线(如图所示),其中物质A常用于铅酸蓄电池中,其浓溶液有脱水性;物质C是人体胃液中的主要成分(提示:碳酸钡不溶于水)