题目内容
10.某溶液中含AgNO3、Cu(NO3)2、Zn(NO3)2,某课外活动小组的间学将A、B、C、D四份,各加入一定量的铁粉.充分反应后过滤,洗涤,分别得到滤渣和滤液.(1)向A所得滤液中滴加稀盐酸,有白色沉淀产生,则滤渣组成是Ag,滤液中含有的溶质是Zn(NO3)2、Fe(NO3)2、AgNO3和Cu(NO3)2.
(2)向B所得滤液中滴加氢氧化钠,有蓝色沉淀产生,则滤渣中一定含有Ag,可能含有Cu,滤液中一定含有的阳离子是Zn2+、Fe2+、Cu2+.
(3)将C所得滤渣加入到稀盐酸中没有气泡产生,则滤渣中一定含有Ag,可能含有Cu,滤液中一定含有的阳离子是Zn2+、Fe2+,可能含有的阳离子是Ag+、Cu2+.
(4)将D所得滤渣加入到稀盐酸中有气泡产生,则滤渣组成是Ag、Cu和Fe,滤液中含有的溶质是Zn(NO3)2和Fe(NO3)2.
分析 根据金属活动性顺序的应用及物质间的反应回答,锌、铁、铜、银的活动性为锌>铁>氢>铜>银,故铁能和AgNO3和Cu(NO3)2反应,溶液中有两种金属离子时,铁粉首先要置换金属活动性弱的金属--银,反应进行的程度由各物质的量的多少决定.
解答 解:(1)若向A得到的滤液中滴加稀盐酸,有白色沉淀生成,说明滤液中含有AgNO3,那么铁就完全反应且铁的量少,只能置换一部分的银,硝酸铜还没有发生反应,故滤液中的溶质有Zn(NO3)2、Fe(NO3)2、AgNO3和Cu(NO3)2;
(2)若将B所得滤液中滴加氢氧化钠,有蓝色沉淀产生,说明溶液中含有Zn(NO3)2、Fe(NO3)2、Cu(NO3)2,可能含有AgNO3,滤液中一定含有Zn2+、Fe2+、Cu2+;滤渣中一定含有银,有没有铜,不能确定,因为铁在溶液中会先置换活动性弱的银,故滤渣中一定很有银.可能含有铜.
(3)若将C得到的滤渣加入到稀盐酸中没有气泡产生,说明滤渣中铁没有剩余,有没有铜,不能确定,因为铁在溶液中会先置换活动性弱的银,故滤渣中一定很有银.滤液中一定含有Zn(NO3)2、Fe(NO3)2,可能含有AgNO3和Cu(NO3)2;
(4)若将D得到的滤渣加入到稀盐酸中有气泡产生,说明滤渣中含有铁,铁有剩余,AgNO3和Cu(NO3)2两种溶质就完全反应,那么滤液中的溶质就只有Zn(NO3)2和Fe(NO3)2,滤渣中一定含有Ag、Cu和Fe;
故答案为:(1)Ag;Zn(NO3)2、Fe(NO3)2、AgNO3和Cu(NO3)2;
(2)Ag;Cu;Zn2+、Fe2+;Ag+、Cu2+;
(3)Ag;Cu;Zn2+、Fe2+;Fe2+、Cu2+;
(4)Ag、Cu和Fe;Zn(NO3)2和Fe(NO3)2.
点评 如果溶液是两种金属的盐溶液,另一种活泼金属置换溶液中的金属时,先置换活动性弱的金属.

| A. |  干燥氢气 | B. |  检验氧气是否集满 | ||
| C. |  检验X溶液中是否含有SO42- | D. |  验证Zn、Fe、Cu的活动性强弱 |
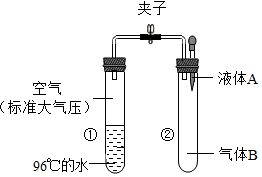 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )| A. | 水、一氧化碳气体 | B. | 硫酸、氮气 | ||
| C. | 硝酸银溶液、氯化钡粉末 | D. | 氢氧化钾溶液、二氧化碳气体 |
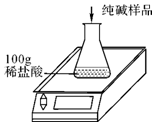 侯氏制碱法得到的纯碱产品中常含有少量氯化钠杂质.实验中取30g纯碱样品,平均分成五等份(每等分6克)依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表(假设反应产生气体全部逸出,其它物质的挥发忽略不计):
侯氏制碱法得到的纯碱产品中常含有少量氯化钠杂质.实验中取30g纯碱样品,平均分成五等份(每等分6克)依次加入到盛有100g稀盐酸的锥形瓶中(锥形瓶的质量为60g),每次充分反应后都进行称量,得到的实验数据如下表(假设反应产生气体全部逸出,其它物质的挥发忽略不计):| 第一次 | 第二次 | 第三次 | 第四次 | 第五次 | |
| 加入纯碱样品的质量/g | 6 | 6 | 6 | 6 | 6 |
| 电子天平的示数/g | 163.8 | 167.6 | 171.4 | 177.4 | 183.4 |
(2)列式计算纯碱样品中碳酸钠的质量分数 (计算结果精确到0.1%).
| A. |  表示一定量的木炭还原氧化铜,剩余固体质量与反应时间的关系 | |
| B. |  表示t℃时,向饱和硝酸钾溶液中加入硝酸钾晶体,溶质质量分数与加入量的关系 | |
| C. |  表示一定量的稀硫酸与锌粒反应,溶液的质量与反应时间的关系 | |
| D. |  表示向硫酸和硫酸铜混合溶液中加入氢氧化钠,沉淀质量与加入量的关系 |

 某澄清溶液由HCl、H2SO4、MgCl2、CuCl2、NaNO3五种中的一种或几种混成.
某澄清溶液由HCl、H2SO4、MgCl2、CuCl2、NaNO3五种中的一种或几种混成.