题目内容
6.四只烧杯中分别盛有稀盐酸,并滴加了数滴石蕊试液.现向这四只烧杯中不断加入下列物质,直至过量,其中能使溶液最后呈紫色的物质是( )| A. | Na2SO4 | B. | Zn (OH)2 | C. | Na2O | D. | KOH |
分析 根据已有的知识进行分析,紫色石蕊试液在中性溶液中为紫色.
解答 解:A、硫酸钠不与盐酸反应,溶液一直呈酸性,石蕊为红色,错误;
B、盐酸能与氢氧化锌反应生成氯化锌和水,氯化锌的水溶液呈中性,氢氧化锌过量则盐酸全部耗尽,氢氧化锌是不溶于水的碱,故最终溶液呈中性,石蕊呈紫色,正确;
C、氧化钠与水反应生成的氢氧化钠能与盐酸反应生成氯化钠,氧化钠过量,则与水反应生成的氢氧化钠的水溶液呈碱性,石蕊为蓝色,错误;
D、盐酸能与氢氧化钾反应生成氯化钾和水,氢氧化钾过量,则溶液呈碱性,石蕊为蓝色,错误.
故选B.
点评 本题考查了常见物质间的反应以及酸碱指示剂的性质,完成此题,可以依据已有的知识进行,要求同学们加强课本知识的识记,以便灵活应用.

练习册系列答案
 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
17. 如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )
如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )
 如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )
如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )| A. | t1℃时,AB两物质的溶解度相等.两杯溶液均是不饱和溶液 | |
| B. | t1℃升高到t2℃时,A物质的溶液的溶质质量分数变小,B物质的溶液溶质质量分数不变 | |
| C. | t2℃时,A的溶解度比B的溶解度大,两杯溶液均是不饱和溶液 | |
| D. | t2℃时,A的溶解度比B的溶解度大,A溶液为不饱和溶液,B溶液为饱和溶液 |
11.下列四个图象中,能正确表示对应变化关系的是( )


| A. | ①表示向一定量稀盐酸中加水稀释 | |
| B. | ②表示一定温度下,向不饱和硝酸钾溶液中加入硝酸钾 | |
| C. | ③表示加热一定量的高锰酸钾固体 | |
| D. | ④表示向盐酸和氯化镁的混合溶液中滴加氢氧化钾溶液 |
18.下列实验设计或操作,能达到实验目的是( )
| A. |  干燥氢气 | B. |  检验氧气是否集满 | ||
| C. |  检验X溶液中是否含有SO42- | D. |  验证Zn、Fe、Cu的活动性强弱 |
15.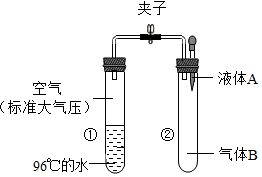 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )| A. | 水、一氧化碳气体 | B. | 硫酸、氮气 | ||
| C. | 硝酸银溶液、氯化钡粉末 | D. | 氢氧化钾溶液、二氧化碳气体 |
16.印制电路板时常用氯化铁溶液作为“腐蚀液”,发生的反应为,Fe+2FeCl3═3FeCl2,2FeCl3+Cu═2FeCl2+CuCl2,向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
| A. | 烧杯中有铁无铜 | B. | 烧杯中有铜无铁 | C. | 烧杯中铁、铜都有 | D. | 烧杯中铁、铜都无 |

