题目内容
5. “空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:
“空气中氧气含量的测定”有多种方法.甲生设计了如图1如示的实验方案:在燃烧匙内盛过量红磷,点燃后立即插入集气瓶内,塞紧橡皮塞,待红磷火焰熄灭,集气瓶冷却至室温,打开铁夹,水注入集气瓶.回答下列问题:(1)反应结束后,打开铁夹,水自动注入集气瓶的直接原因是红磷燃烧消耗了氧气,氧气的消耗导致装置内的压强减小
(2)乙生也设计了一个如图2所示的实验方案,装置和操作同甲类似,只不过用硫粉代替了红磷,并增加了滴管.要使实验成功,乙在滴管中应加入某溶液,写出该溶液发生反应的化学方程SO2+2NaOH=Na2SO3+H2O.
分析 (1)空气成分的测定实验的原理是利用某种物质燃烧消耗空气中某一成分,导致装置内的压强减小,从而使等体积液体倒流进入装置内.
(2)根据硫粉燃烧生成二氧化硫气体,二氧化硫气体能被氢氧化钠溶液吸收进行分析.
解答 解:(1)实验中加入过量的红磷以把空气中的氧气尽可能的消耗掉,而氧气的消耗会导致装置内的压强减小,从而使等体积液体倒流进入装置内;故填:红磷燃烧消耗了氧气,氧气的消耗导致装置内的压强减小;
(2)硫粉燃烧生成二氧化硫气体,而二氧化硫气体能被氢氧化钠溶液吸收,因此滴管中应加入氢氧化钠溶液溶液,二氧化硫与氢氧化钠反应生成亚硫酸钠和水;故填:SO2+2NaOH=Na2SO3+H2O.
点评 本题综合考查了空气成分的测定实验及本实验的误差分析,要从反应物和生成物的状态进行分析解答.

练习册系列答案
 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案
相关题目
16.鉴别下列各组无色溶液,所选试剂或方法正确的是( )
| 选项 | 待鉴别物质 | 所选试剂(均为溶液)或方法 |
| A | 氧化铜和四氧化三铁 | 观察颜色 |
| B | CH4和H2 | 点燃,检验产物 |
| C | AgNO3和K2SO4 | BaCl2 |
| D | HNO3和NaNO3 | 酚酞 |
| A. | A | B. | B | C. | C | D. | D |
10.如表是某种雪碧汽水标签中的部分内容,小明同学通过查阅资料得知:柠檬酸的化学式为C6H8O7,是一种无色晶体,能溶于水,属于有机物(填有机物或无机物),具有酸的通性.香料、苯甲酸钠、白砂糖等不显酸性.小明想利用此雪碧汽水验证柠檬酸的酸性.他首先将适量的雪碧汽水倒入一洁净的试管中,然后滴加紫色石蕊试液,发现试液变红色.据此,小明断定柠檬酸确实具有酸性.可他仔细一想,发现实验结论不够严密,他的理由是汽水中的碳酸也能使石蕊试液变红.
| 品名 | 雪碧汽水(清爽柠檬味) |
| 配料 | 碳酸水(水、二氧化碳) 白砂糖、柠檬酸、香料、 苯甲酸钠 |
| 保质期 | 18个月 |
| 注意 | 禁止加热、避免阳光直晒 |
17. 如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )
如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )
 如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )
如图是A、B两种物质的溶解度曲线.在t1℃时往两个盛有100克水的烧杯中分别加入a克A物质和b克B物质,充分搅拌后都加热到t2℃.下列说法正确的是( )| A. | t1℃时,AB两物质的溶解度相等.两杯溶液均是不饱和溶液 | |
| B. | t1℃升高到t2℃时,A物质的溶液的溶质质量分数变小,B物质的溶液溶质质量分数不变 | |
| C. | t2℃时,A的溶解度比B的溶解度大,两杯溶液均是不饱和溶液 | |
| D. | t2℃时,A的溶解度比B的溶解度大,A溶液为不饱和溶液,B溶液为饱和溶液 |
15.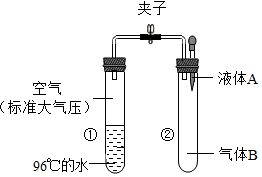 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
 如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与物体B充分混合,打开夹子,可发现试管①内刚停止加热沸腾的水又立刻沸腾了.则液体A和物体B的组合最可能的是( )| A. | 水、一氧化碳气体 | B. | 硫酸、氮气 | ||
| C. | 硝酸银溶液、氯化钡粉末 | D. | 氢氧化钾溶液、二氧化碳气体 |


