题目内容
6. 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.【应用研究】(1)汽车经撞击后,30毫秒内引发NaN3,迅速分解为Na、N2,反应方程式为2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
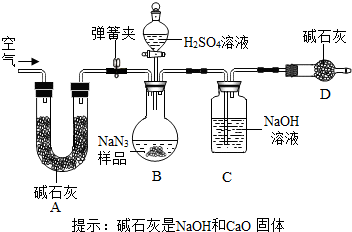
【制备研究】(2)将金属钠与液态氨反应得NaNH2,再将NaNH2与N2O反应可生成NaN3、NaOH和气体X,该反应的化学方程式为2NaNH2+N2O═NaN3+NaOH+X,实验室X气体使湿润的红色石蕊试纸变蓝,工业级NaN3中常含有少量的Na2CO3,为测定样品中Na2CO3的质量分数设计如图装置(已知H2SO4溶液与NaN3,反应不生成气体).
(3)设计的实验步骤为:①精确称量样品,检查装置气密性;②打开弹簧夹,鼓入空气,称量装置C;③关闭弹簧夹,打开分液漏斗活塞;④再打开弹簧夹,缓缓鼓入空气;⑤再次称量装置C.写出②、④两步操作的作用:除去鼓入空气中的CO2和水蒸气;将装置中残留的二氧化碳全部排入BC装置.
分析 (1)根据信息判断反应物、生成物、反应条件,然后写出方程式.
(2)根据质量守恒定律的实质来判断X的化学式.
(3)根据碱石灰的成分和用途来完成第一空的解答即可,而④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
解答 解:(1)汽车经撞击后,30毫秒内引发NaN3迅速分解为Na、N2,即反应物是NaN3,生成物是Na、N2,条件是撞击,所以反应方程式为 2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑.
(2)根据质量守恒定律,反应前后原子的种类和数目不变,可确定气体X的化学式为:NH3.
(3)②打开弹簧夹,鼓入空气,称量装置C;碱石灰的主要成分是氧化钙和氢氧化钠,二者既能吸收水分,又能吸收二氧化碳气体,所以作用是除去空气中的二氧化碳和水蒸气;④再打开弹簧夹,鼓入空气能将装置中残留的二氧化碳全部排入BC装置.
答案:(1)2NaN3$\frac{\underline{\;撞击\;}}{\;}$2Na+3N2↑;(3)除去鼓入空气中的CO2和水蒸气,将装置中残留的二氧化碳全部排入BC装置.
点评 综合实验涉及知识面广,对学生思维能力要求高,既考查知识的识记、理解、迁移、运用,又考查分析、对比、归纳等思维能力,符合素质教育培养学生能力的要求,是中考方向,对这类题目要重点训练.

练习册系列答案
相关题目
11.在下列生活和生产过程中,发生了化学变化的是( )
| A. | 矿石粉碎 | B. | 海水晒盐 | C. | 谷物酿酒 | D. | 石头雕像 |
14.现在有部分氧化的镁6.4克与100克14.6%稀盐酸恰好完全反应,产生的氢气质量为( )
| A. | 0.1g | B. | 0.2g | C. | 0.3g | D. | 0.4g |
16.某兴趣小组为了测定葡萄糖的元素组成,取一定量的葡萄糖与氧气反应,并通过测定生成CO2和H2O的质量来确定葡萄糖中元素的组成.实验装置如图,其中CuO的作用是防止反应不完全生成CO,NaOH固体、CaCl2固体、碱石灰都是常用的干燥剂.回答下列问题:

(1)将如图装置连接成整套实验装置,连接顺序依次为A→C→B→D(填字母).
(2)实验过程中数据记录如下:
反应中生成水的质量是n-mg(用M、N或m、n表示).
(3)若实验不连接装置D,则测得的CO2质量偏大,原因是装置B中的氢氧化钠固体吸收了空气中的二氧化碳和水.

(1)将如图装置连接成整套实验装置,连接顺序依次为A→C→B→D(填字母).
(2)实验过程中数据记录如下:
| 装置 | 反应前装置的质量/g | 反应后装置的质量/g |
| B | M | N |
| C | m | n |
(3)若实验不连接装置D,则测得的CO2质量偏大,原因是装置B中的氢氧化钠固体吸收了空气中的二氧化碳和水.

 春天是流感的多发季节,民间有很多治疗流感的小偏方,其中多吃大蒜能预防感冒.大蒜中的大蒜素硫化丙烯是杀菌的有效成分,1千克大蒜中含大蒜素125克,已知大蒜素由C、H、S三种元素组成,相对分子质量为74,其中碳元素质量分数48.6%,氢元素质量分数8.1%,求:
春天是流感的多发季节,民间有很多治疗流感的小偏方,其中多吃大蒜能预防感冒.大蒜中的大蒜素硫化丙烯是杀菌的有效成分,1千克大蒜中含大蒜素125克,已知大蒜素由C、H、S三种元素组成,相对分子质量为74,其中碳元素质量分数48.6%,氢元素质量分数8.1%,求: