题目内容
18. 春天是流感的多发季节,民间有很多治疗流感的小偏方,其中多吃大蒜能预防感冒.大蒜中的大蒜素硫化丙烯是杀菌的有效成分,1千克大蒜中含大蒜素125克,已知大蒜素由C、H、S三种元素组成,相对分子质量为74,其中碳元素质量分数48.6%,氢元素质量分数8.1%,求:
春天是流感的多发季节,民间有很多治疗流感的小偏方,其中多吃大蒜能预防感冒.大蒜中的大蒜素硫化丙烯是杀菌的有效成分,1千克大蒜中含大蒜素125克,已知大蒜素由C、H、S三种元素组成,相对分子质量为74,其中碳元素质量分数48.6%,氢元素质量分数8.1%,求:(1)1千克大蒜中含氢元素10.125克,S元素的质量分数为43.3%.
(2)硫化丙烯的化学式为C3H6S.
分析 (1)根据公式:元素的质量=物质的总质量×该元素的质量分数可求;
由大蒜素由C、H、S三种元素组成,其中碳元素质量分数48.6%,氢元素质量分数8.1%,所以硫元素的质量分数为:1-48.6%-8.1%=43.3%;
(2)根据公式:某元素的质量分数=$\frac{该元素原子相对原子质量×原子个数}{相对分子质量}$×100%可知:
某物质一个分子中原子个数=$\frac{某元素的质量分数×相对分子质量}{该元素原子相对原子质量}$可求;
解答 解:(1)由题意可知:1千克大蒜中含大蒜素125克.根据公式:元素的质量=物质的总质量×该元素的质量分数可得:1千克大蒜中含氢元素的质量为:125g×8.1%=10.125g;
由大蒜素由C、H、S三种元素组成,其中碳元素质量分数48.6%,氢元素质量分数8.1%,所以硫元素的质量分数为:1-48.6%-8.1%=43.3%;
故答案为:10.125 43.3%;
(2)根据公式:某元素的质量分数=$\frac{该元素原子相对原子质量×原子个数}{相对分子质量}$×100%可知:
某物质一个分子中原子个数=$\frac{某元素的质量分数×相对分子质量}{该元素原子相对原子质量}$;故一个硫化丙烯分子中碳原子的个数=$\frac{48.6%×74}{12}$=3;同理可得:一个硫化丙烯分子中氢原子的个数=$\frac{8.1%×74}{1}$=6;一个硫化丙烯分子中硫原子的个数=$\frac{43.3%×74}{32}$=1;故硫化丙烯的化学式为:C3H6S;故答案为:C3H6S.
点评 本题主要考查化学式的意义和有关计算,难度稍大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.电石是一种灰色的块状固体.化学式为CaC2.它能与水发生剧烈的化学反应,生成一种可燃性气体乙炔(化学式为C2H2)和一种白色固体.
(1)CaC2中C的化合价为-1.
(2)对白色固体的成分做出猜想,猜想一:CaO,猜想二:CaCO3,你认为猜想甲不成立理由是氧化钙能与水反应生成氢氧化钙.
(3)如果你的猜想不同与它们,那么你猜想的白色固体是什么?请你设计一个实验方案来证明你的猜想是正确的,并填写在下列表格中.
(4)写出电石与水反应的方程式CaC2+2H2O=Ca(OH)2+C2H2↑.
(1)CaC2中C的化合价为-1.
(2)对白色固体的成分做出猜想,猜想一:CaO,猜想二:CaCO3,你认为猜想甲不成立理由是氧化钙能与水反应生成氢氧化钙.
(3)如果你的猜想不同与它们,那么你猜想的白色固体是什么?请你设计一个实验方案来证明你的猜想是正确的,并填写在下列表格中.
| 提出问题,白色固体是什么 | 实验操作 | 实验现象 | 实验结论 |
| 白色固体是氢氧化钙 | 将固体加入足量水中溶解,过滤,在滤液中加入Na2CO3溶液(不能用酸碱指示剂) | 产生白色沉淀 | 猜想成立 |
7.初中科学实验中,有许多涉及操作上的“先”与“后”的问题,如果把“先”与“后”顺序颠倒,就会影响实验效果或导致事故的发生.下列描述的实验操作中“先”“后”顺序正确的是( )
| A. | 使用显微镜观察细胞时,先调节细准焦螺旋,后调节粗准焦螺旋 | |
| B. | 稀释浓硫酸时先将浓硫酸倒入烧杯中,后将水沿着烧杯壁慢慢倒入浓硫酸中 | |
| C. | 用氢气还原氧化铜时,应先通氢气一会儿,后点燃酒精灯加热 | |
| D. | 实验室制取氧气,停止加热时,应先熄灭酒精灯,再把导管移出水面 |

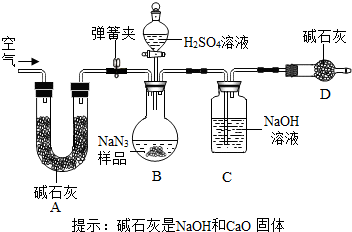 叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
叠氮化钠(NaN3)被广泛应用于汽车安全气囊,某兴趣小组对其进行下列研究.
