题目内容
14.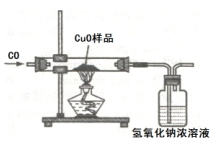 金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)
金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)(1)该实验利用了一氧化碳的还原性.
(2)甲同学的方法:先测出氢氧化钠浓溶液的质量为50克,待反应完全后再次称量,质量为54.4克.请你计算样品中氧化铜的质量分数:80%.(一氧化碳不与氢氧化钠溶液反应)
(3)乙同学的方法:先称量出玻璃管及样品的总质量为m1,待反应完全后再次称量,质量为m2,利用m1-m2的值,求出样品中氧化铜的质量分数.其中m1-m2的值是指氧化铜中氧元素的质量.
分析 一氧化碳具有还原性,加热条件下能和氧化铜反应生成铜和二氧化碳,根据反应的化学方程式及其提供的数据可以进行相关方面的计算.
解答 解:(1)该实验利用了一氧化碳的还原性.
故填:还原.
(2)设氧化铜质量为x,
反应生成二氧化碳质量为:54.4g-50g=4.4g,
CuO+CO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+CO2,
80 44
x 4.4g
$\frac{80}{x}$=$\frac{44}{4.4g}$,
x=8g,
样品中氧化铜的质量分数为:$\frac{8g}{10g}$×100%=80%,
故填:80%.
(3)m1-m2的值是指氧化铜中氧元素的质量,根据氧元素质量可以计算氧化铜质量,进一步可以计算氧化铜质量分数.
故填:氧化铜中氧元素.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列除去杂质的方法中,正确的是( )
| 选项 | 物质(括号内为杂质) | 去除杂质的方法 |
| A | NaCl(Na2CO3) | 加入适量的Ca(OH)2溶液、过滤 |
| B | CaO(CaCO3) | 加水、过滤 |
| C | CaCl2(HCl) | 加过量石灰石、过滤 |
| D | H2SO4(HNO3) | 加Ba(NO3)2溶液、过滤 |
| A. | A | B. | B | C. | C | D. | D |
5.石灰石是我省的主要矿产之一.学校研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份进行实验
(CaCO3+2HCl═CaCl2+H2O+CO2↑),结果如下表:
(1)哪几次反应中碳酸钙有剩余?3、4
(2)上表中m的值是4.4
(3)试计算这种石灰石中碳酸钙的质量分数.
(CaCO3+2HCl═CaCl2+H2O+CO2↑),结果如下表:
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成的CO2质量/g | 1.76 | 3.52 | 4.4 | m |
(2)上表中m的值是4.4
(3)试计算这种石灰石中碳酸钙的质量分数.
2.某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤液中加入少量的稀盐酸,无沉淀产生,则下列有关说法中正确的是( )
| A. | 滤液中一定含有硝酸亚铁,一定没有硝酸银 | |
| B. | 滤液中一定含有有硝酸亚铁,可能含有硝酸银和硝酸铜 | |
| C. | 滤出的固体中一定含有铜,可能含有银 | |
| D. | 滤出的固体中一定含有银和铜,一定不含有铁 |
9.将少量下列物质分别放入水中,充分搅拌,不能得到溶液的是( )
| A. | 蔗糖 | B. | 食盐 | C. | 酒精 | D. | 胡椒粉 |
6.下列化学实验操作正确的是( )
| A. |  倾倒液体 | B. |  检查装置气密性 | C. |  加热高锰酸钾 | D. |  滴加液体 |
