题目内容
3.现有下列仪器:①酒精灯 ②量筒 ③试管 ④胶头滴管 ⑤烧杯 ⑥药匙 ⑦玻璃棒⑧托盘天平.若实验室要配制100克15%的氯化钠溶液,则上述仪器中多余的是( )| A. | ②④ | B. | ①③ | C. | ⑤⑥ | D. | ⑦⑧ |
分析 实验室配制100g15%的NaCl溶液操作步骤分别是:计算、称量、溶解,根据各操作所需要使用的仪器,判断所列仪器是否需要.
解答 解:实验室配制100g15%的NaCl溶液操作步骤分别是:计算、称量、溶解,药匙用于取用氯化钠,托盘天平用于称取固体氯化钠、量筒与胶头滴管用于准确量取水、烧杯用于完成溶解操作、玻璃棒用于溶解时的搅拌,故上述仪器中多余的是:①酒精灯、③试管.
故选:B.
点评 本题难度不大,明确配制一定溶质质量分数的溶液实验步骤(计算、称量、溶解)、所需的仪器是正确解答本题的关键.

练习册系列答案
相关题目
8.如图所示的实验基本操作,不正确的是( )
| A. |  用测电笔辨别零线和火线 | B. |  检验装置气密性 | ||
| C. |  熄灭酒精灯 | D. |  稀释浓硫酸 |
15.甲、乙、丙、丁四位同学对氯化镁样品(仅含氯化钠杂质)进行检测:各取10.0克样品溶于一定量的水得到45.8克溶液,再分别加入不同质量、溶质质量分数相同的氢氧化钠溶液,所加氢氧化钠溶液和反应得到沉淀的实验数据如表:
已知2NaOH+MgCl2═2NaCl+Mg(OH)2↓,试回答下列问题:
(1)上述实验数据表明,配成溶液后的10.0克样品与氢氧化钠反应产生沉淀质量最多是1.45克.
(2)10.0克样品中氯化镁的质量是多少?
(3)计算丙同学实验后所得溶液的溶质质量分数是多少?
| 甲 | 乙 | 丙 | 丁 | |
| 加入氢氧化钠溶液质量(g) | 10.0 | 20.0 | 40.0 | 60.0 |
| 反应得到沉淀的质量(g) | 1.45 | 2.9 | 5.8 | 5.8 |
(1)上述实验数据表明,配成溶液后的10.0克样品与氢氧化钠反应产生沉淀质量最多是1.45克.
(2)10.0克样品中氯化镁的质量是多少?
(3)计算丙同学实验后所得溶液的溶质质量分数是多少?
5.走进华能长兴电厂,庞大的建筑物和高高的烟囱映入眼帘,这些就是低低温省煤器、低低温电除尘和高效除尘脱硫吸收塔,华能长兴电厂采用烟气协同治理的关键技术,通过这些设备,大大降低了烟尘、二氧化硫和氮氧化物的排放值.下列环保效果不是这些设备所能起的是( )
| A. | 减少空气中可吸入颗粒物的含量 | B. | 缓和温室效应 | ||
| C. | 减少酸雨的发生 | D. | 防止臭氧层空洞进一步扩大 |
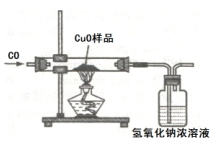 金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)
金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)