题目内容
19.“碳捕捉技术”是指通过一定的方法将工业生产中产生的CO2分离出来并利用.如何利用NaOH溶液来“捕捉”CO2,其基本过程如下图所示(部分条件及物质未标出).
(1)整个工业生产过程中,可以循环利用物质有氢氧化钠、氧化钙.
(2)“反应分离”环节中,分离的基本操作是过滤.
(3)“反应分离”环节中,发生了复分解反应的化学方程式Ca(OH)2+Na2CO3=CaCO3↓+2NaOH.“高温反应炉”中的化学方程式CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
分析 根据题干提供的信息进行分析,捕捉室中含有氢氧化钠溶液,氢氧化钠能与二氧化碳反应生成碳酸钠和水;氧化钙能与水反应生成氢氧化钙,氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钙可以高温分解生成氧化钙和二氧化碳,进行分析.
解答 解:(1)由题意可知,碳酸钠与氢氧化钙反应生成了的氢氧化钠和碳酸钙高温分解的氧化钙是可以循环利用的;
(2)在“反应分离”中发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,所以分离CaCO3和NaOH用过滤操作;
(3)在“反应分离”中发生的反应有CaO+H2O=Ca(OH)2,Ca(OH)2+Na2CO3=CaCO3↓+2NaOH,其中Ca(OH)2+Na2CO3=CaCO3↓+2NaOH属于复分解反应;
“高温反应炉”内发生反应是碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式是:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
故答案为:(1)氢氧化钠、氧化钙;(2)过滤;(3)Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
点评 本题考查了减少二氧化碳排放的方法,完成此题,可以依据已有的物质的性质进行.

练习册系列答案
相关题目
9.下列化学方程式正确的是( )
| A. | 2Fe+6HCl═2FeCl3+3H2↑ | B. | 2Al+3CuCl2═2AlCl3+3Cu | ||
| C. | Mg+2AgCl═MgCl2+2Ag | D. | BaCl2+Mg(NO3)2═Ba(NO3)2↓+MgCl2 |
7.在电解水的实验中,如果生成氢气的体积为5厘米3,则生成的氧气的体积为( )
| A. | 10厘米3 | B. | 2.5厘米3 | C. | 5厘米3 | D. | 1厘米3 |
4.中科院的全超导的“人造太阳”--托克马克核聚变试验装置的调试运行成功,使我国在该领域的研究处于世界前列.氘和氚是核聚变的原料(氘、氚原子核内都只有1个质子,中子数分别为1和2),聚变发生后,氘、氚原子核转变为氦原子核.根据以上叙述,下列说法正确的是( )
| A. | 氘原子和氚原子属于不同种元素 | |
| B. | 氦原子核内含2个电子 | |
| C. | 氚原子中有一个电子 | |
| D. | 氘原子和氚原子的原子质量分别为2和3 |
8.如图所示的实验基本操作,不正确的是( )
| A. |  用测电笔辨别零线和火线 | B. |  检验装置气密性 | ||
| C. |  熄灭酒精灯 | D. |  稀释浓硫酸 |




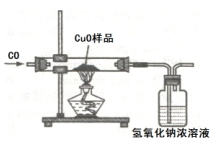 金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)
金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)
