题目内容
2.某金属加工厂生产过程中的废液含有少量的硝酸银和硝酸铜,为回收利用资源和防止污染,该厂向废液中加入一定量的铁粉,反应停止后过滤,向滤液中加入少量的稀盐酸,无沉淀产生,则下列有关说法中正确的是( )| A. | 滤液中一定含有硝酸亚铁,一定没有硝酸银 | |
| B. | 滤液中一定含有有硝酸亚铁,可能含有硝酸银和硝酸铜 | |
| C. | 滤出的固体中一定含有铜,可能含有银 | |
| D. | 滤出的固体中一定含有银和铜,一定不含有铁 |
分析 在金属活动性顺序中,铁排在铜和银的前边,可以和硝酸银及硝酸铜溶液反应,生成银和铜以及硝酸亚铁,向滤液中加入少量的稀盐酸,无沉淀产生,说明滤液中没有硝酸银.
解答 解:由题意可知,在金属活动性顺序中,铁排在铜和银的前边,可以和硝酸银及硝酸铜溶液反应,生成银和铜以及硝酸亚铁.向滤液中加入少量的稀盐酸,无沉淀产生,说明滤液中一定没有硝酸银.滤出的固体中一定有银.滤液中一定有硝酸亚铁.由以上分析可知:
A、滤液中一定有硝酸亚铁,一定没有硝酸银,可能含有硝酸铜.故正确.
B、滤液中一定有硝酸亚铁,一定没有硝酸银,无法确定是否含有硝酸铜.故错误;
C、滤出的固体中一定含有银,无法确定是否含有铜,可能含有铜和铁.故错误;
D、滤出的固体中一定含有银,如果可能有铜和铁.故错误;
故选:A.
点评 本题考查的金属与混合盐溶液的反应,完成此题,可以依据金属活动性顺序以及题干提供的信息进行.所以要求同学们在平时的学习中加强基础知识的记忆,以便能够灵活应用.

练习册系列答案
相关题目
17.关于质量守恒定律的理解,错误的是( )
| A. | 实际参加反应的反应物总质量等于生成物总质量 | |
| B. | 反应前后原子种类和个数不变 | |
| C. | 1g氢气和1g氧气反应能生成2g水 | |
| D. | 煤燃烧后灰渣质量小于煤,也能用质量守恒定律解释 |
7.在电解水的实验中,如果生成氢气的体积为5厘米3,则生成的氧气的体积为( )
| A. | 10厘米3 | B. | 2.5厘米3 | C. | 5厘米3 | D. | 1厘米3 |





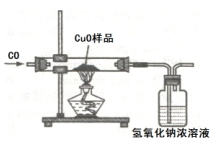 金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)
金属的冶炼时,某学习小组用如图所示的装置测量氧化铜样品中氧化铜的质量分数,实验所取氧化铜样品质量为10克.(所含杂质不参加反应)