题目内容
17.元素周期律和元素周期表是研究化学的重要工具.下表是元素周期表的部分信息.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 第二 周期 | 3 Li 锂 7 | 4 Be 铍 9 | 5 B 硼 11 | ① | 7 N 氮 14 | 8 O 氧 16 | 9 F 氟 19 | 10 Ne 氖 20 |
| 第三 周期 | 11 Na 钠 23 | ② | 13 Al 铝 27 | 14 Si 硅 28 | ③ | 16 S 硫 32 | 17 Cl 氯 35.5 | 18 Ar 氩 40 |
(1)地壳中含量最多的金属元素的原子序数是13;
(2)
 表示的是S2- (写粒子符号);
表示的是S2- (写粒子符号);(3)原子序数为9和20的两种元素组成的化合物是CaF2(写化学式);
(4)从原子结构角度看,同一周期元素的原子具有相同的电子层数.
(5)图
 是氯元素的原子结构示意图,图上表中与氯元素在同一纵行的氟元素,其原子结构与氯原子相似.由此推测,氟原子在化学反应中易得(填“得”或“失”)个电子.“②”处元素在化合物中显+2 价.
是氯元素的原子结构示意图,图上表中与氯元素在同一纵行的氟元素,其原子结构与氯原子相似.由此推测,氟原子在化学反应中易得(填“得”或“失”)个电子.“②”处元素在化合物中显+2 价.
分析 (1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,从元素周期表查出铝原子序数;
(2)根据结构示意图,可判断该粒子的质子数,从而可确定该粒子所属的元素;根据结构示意图中质子数与核外电子数的关系,可判断该粒子为原子还是离子.
(3)9、20号元素分别是氟元素、钙元素,它们组成的化合物为氟化钙,写出其化学式即可;
(4)根据从原子结构角度看,同一周期元素的原子具有相同的电子层数解答;
(5)非金属元素的最外层电子数一般多于4,在化学反应中易得到电子达到8电子的稳定结构.
解答 解:(1)根据地壳里各元素的含量由多到少的顺序排列依次是氧,硅,铝,铁,因此地壳中含量最多的金属元素是Al;从元素周期表查出铝原子序数为13;故填:13;
(2)由结构示意图可知,该粒子核内有16个质子,可确定该粒子为硫元素的粒子;由于核外有18个电子,大于核内质子数,可确定该粒子为带2个单位负电荷的阴离子;因此该粒子的符号为S2-;
(3)9、20号元素分别是氟元素、钙元素,它们组成的化合物为氟化钙,其组成的化合物的化学式为:CaF2;
(4)从原子结构角度看,同一周期元素的原子具有相同的电子层数;
(5)金属元素的最外层电子数一般多于4,在化学反应中易得到电子达到8电子的稳定结构,从而氟原子形成带一个单位负电荷的阴离子;②是镁元素,易失去两个电子形成带2个单位正电荷的镁离子,在化合物中显+2价.
答案:
(1)13;
(2)S2-;
(3)CaF2;
(4)电子层;
(5)得;+2.
点评 本题难度不大,考查学生灵活运用元素周期表中元素的信息进行分析问题、解决问题的能力.

练习册系列答案
相关题目
7.将一小块白色的金属钠放置在空气中会发生下列变化:
钠(Na)$\stackrel{O_{2}}{→}$钠的氧化物$\stackrel{H_{2}O}{→}$氢氧化钠溶液$\stackrel{CO_{2}}{→}$白色固体
【提出问题】常温下钠与氧气反应,产物有哪些?
【查阅资料】钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
【作出猜想】常温下钠与氧气反应的产物
猜想1:Na2O
猜想2:Na2O2
猜想3:Na2O和Na2O2
【实验探究一】:
【作出猜想】
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
【实验反思】
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式Na2O+2HCl=2NaCl+H2O;
(2)能与酸反应只生成盐和水的氧化物为碱性氧化物,请判断Na2O2不是碱性氧化物(填“是”或“不是”).
钠(Na)$\stackrel{O_{2}}{→}$钠的氧化物$\stackrel{H_{2}O}{→}$氢氧化钠溶液$\stackrel{CO_{2}}{→}$白色固体
【提出问题】常温下钠与氧气反应,产物有哪些?
【查阅资料】钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O═2NaOH;2Na2O2+2H2O═4NaOH+O2↑
【作出猜想】常温下钠与氧气反应的产物
猜想1:Na2O
猜想2:Na2O2
猜想3:Na2O和Na2O2
【实验探究一】:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量钠的氧化物加入足量蒸馏水 | 不产生气泡 | 猜想1正确 |
猜想一:Na2CO3
猜想二:Na2CO3和NaOH
| 实验操作 | 实验现象 | 实验结论 |
| 1.取少量白色固体加入足量 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
| 2.过滤,取少量滤液加入 | 酚酞试液变红色 |
(1)类比氧化铜与盐酸的反应,写出氧化钠与盐酸反应的化学方程式Na2O+2HCl=2NaCl+H2O;
(2)能与酸反应只生成盐和水的氧化物为碱性氧化物,请判断Na2O2不是碱性氧化物(填“是”或“不是”).
5.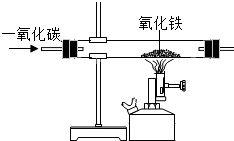 如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )
如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )
 如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )
如图是“一氧化碳与氧化铁反应”的部分实验装置,关于该实验说法正确的是( )| A. | 该实验的反应原理是FeO+CO$\frac{\underline{\;高温\;}}{\;}$ Fe+CO2 | |
| B. | 在实验过程中,黑色的粉末会逐渐变成红色 | |
| C. | 充分反应后,向固体中加稀盐酸会产生气泡 | |
| D. | 在实验过程中,产生的尾气可以直接排放到空气中 |
2.比较推理是化学学习中常用的思维方法,下列推理正确的是( )
| A. | 镁条可在空气中燃烧,故铁丝也可在空气中燃烧 | |
| B. | 金刚石很硬,故石墨也很硬 | |
| C. | 二氧化碳可以灭火,一氧化碳也能灭火 | |
| D. | 生铁比纯铁硬,故黄铜比纯铜硬 |
9.诗词是民族灿烂文化中的瑰宝,下列著名诗句中隐含有化学变化的是( )
①千里冰封,万里雪飘
②白玉为床,金作马
③野火烧不尽,春风吹又生
④粉骨碎身浑不怕,要留清白在人间
⑤夜来风雨声,花落知多少
⑥春蚕到死丝方尽,蜡炬成灰泪始干.
①千里冰封,万里雪飘
②白玉为床,金作马
③野火烧不尽,春风吹又生
④粉骨碎身浑不怕,要留清白在人间
⑤夜来风雨声,花落知多少
⑥春蚕到死丝方尽,蜡炬成灰泪始干.
| A. | ①③⑤ | B. | ②④⑥ | C. | ①③④⑤ | D. | ③④⑥ |
7.如表所示,实验室用过氧化氢溶液和二氧化锰制取氧气,实验的有关数据如下:
(1)反应中二氧化锰的作用是催化作用
(2)反应生成氧气的质量为0.8g(结果精确到0.1g,下同)
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程.
| 气体发生装置内物质的总质量(g) | |
| 反应前 | 35.6 |
| 反应后 | 34.8 |
(2)反应生成氧气的质量为0.8g(结果精确到0.1g,下同)
(3)计算参加反应的过氧化氢的质量,写出必要的计算过程.
