题目内容
9.某碳酸钠样品中混有少量氯化钠,根据图所示信息计算该样品中碳酸钠的质量分数.(计算结果精确到0.1%)(反应的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl)
分析 根据氯化钙和碳酸钠反应生成碳酸钙沉淀和氯化钠,然后结合题中所给的数据进行计算.
解答 解:设该样品中碳酸钠的质为x
CaCl2+Na2CO3=CaCO3↓+2NaCl
106 100
x 5.0g
$\frac{106}{x}=\frac{100}{5.0g}$
x=5.3g
样品中碳酸钠的质量分数=$\frac{5.3g}{7.5g}$×100%≈70.7%.
答:该样品中碳酸钠的质量分数为70.7%
点评 本题难度不大,考查同学们灵活运用化学方程式的有关计算进行分析问题、解决问题的能力.

练习册系列答案
相关题目
19.实验设计是化学实验的重要环节.请根据下列实验要求回答相关问题:
【活动与探究一】用对比实验方法探究二氧化碳的性质.
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
(3)实验三目的是探究温度对硝酸钾溶解性的影响;实验四是探究溶剂种类对物质溶解性的影响,该实验中需要控制的变量是温度和溶质、溶剂的质量相等.
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据下表提供的实验数据,完成如表:
定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果偏小(填“偏小、‘偏大”或“无影响”).
| 实验一 | 实验二 |
 |  |
(1)实验一中振荡3个矿泉本塑料瓶,观察到塑料瓶变瘪的程度为A>B>C,其中变浑浊的瓶内发生反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;对比A瓶与C(填“B”或“C”)瓶的实验现象,可证明CO2能与NaOH发生反应.
(2)实验二观察到C装置中发生的现象是干燥的石蕊试纸无变化,湿润的蓝色石蕊试纸变红色结论是CO2+H2O=H2CO3(用化学方程式表示).
【活动与探究二】用变量控制方法探究影响物质溶解性的因素.
| 实验三 | 实验四 |
 |  |
(4)实验五中,反应的原理为2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO(用化学方程式表示);装置一比装置二更合理,理由是装置一中氧气反应的更充分;
根据下表提供的实验数据,完成如表:
| 硬质玻璃管的容积 | 反应前注射器中气体体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
| 30mL | 20mL | 12mL |
| 实验五 | |
 |  |
20.人类食物供给的总能量中,有70%左右来自糖类,下列物质中富含糖类的是( )
| A. | 玉米 | B. | 豆腐 | C. | 牛奶 | D. | 西红柿 |
17.已知H2S气体与SO2气体混合可迅速反应成硫和水(2H2S+SO2═3S↓+2H2O).在一个密闭的容器内,充入a个H2S分子和b个SO2分子,充分反应后密闭容器中硫原子数和氧原子数之比是( )
| A. | $\frac{a}{b}$ | B. | $\frac{a+b}{2b}$ | C. | $\frac{2a+b}{2b}$ | D. | $\frac{2a}{a+b}$ |
1.下列变化属于化学变化的是( )
| A. | 粗盐(含不溶于水的杂质)提纯 | B. | 用金刚石刻划玻璃 | ||
| C. | 冰融化成水 | D. | 充分加热试管中的火柴头使其燃烧 |
14.人类食物供给的总能量中,有70%左右来自糖类,下列物质中富含糖类的是( )
| A. | 面条 | B. | 豆腐 | C. | 奶油 | D. | 黄瓜 |

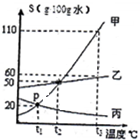 如图是甲、乙、并三种固体物质的溶解度曲线.
如图是甲、乙、并三种固体物质的溶解度曲线.