题目内容
5.BaCl2•2H2O是一种无色透明的晶体,可用于电子、仪表、冶金等工业.工业上采用钡矿粉(主要成分为BaCO3,含有Ca2+、Fe2+、Fe3+、Mg2+等杂质)来制备BaCl2•2H2O,其流程如下: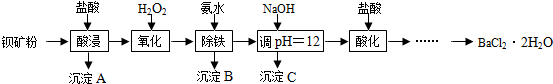
(1)酸浸过程中主要成分发生反应的化学方程式为BaCO3+2HCl=BaCl2+H2O+CO2↑.
(2)沉淀C的主要成分是Ca(OH)2和Mg(OH)2.
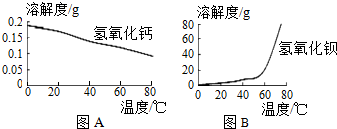
(3)图A、图B分别是氢氧化钙、氢氧化钡的溶解度曲线,据图分析,要使Ca2+更好沉淀,还应采取的措施为升高温度.
(4)实验室用BaSO4沉淀法测定产品中钡元素含量,实验步骤为:
Ⅰ.称取0.6g BaCl2•2H2O试样,加入100mL水使之完全溶解,加入一定量稀盐酸酸化溶液.
Ⅱ.边搅拌边逐滴加入稀硫酸至反应完全.
Ⅲ.过滤、洗涤沉淀3~4次,确认已洗涤干净.
Ⅳ.干燥、称量沉淀后计算出BaCl2•2H2O中钡元素的含量.
①若步骤 I称取的样品过少,则在步骤III洗涤时可能造成的影响为沉淀量少,洗涤造成的损耗大;
②步骤Ⅱ加入稀硫酸至反应完全的判断方法是静置,取上层清液适量于试管中,滴入稀硫酸后不再有沉淀产生.
分析 (1)碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳;
(2)镁离子能和氢氧根离子结合成白色沉淀氢氧化镁;
(3)氢氧化钙的溶解度随着温度升高而减小,氢氧化钡的溶解度随着温度升高而增大;
(4)称取的样品越少,产生的沉淀就越少,洗涤时损耗相对较多,导致的误差会增大;
钡离子和硫酸根离子结合成白色沉淀硫酸钡.
解答 解:(1)酸浸过程中主要成分碳酸钡和稀盐酸发生反应的化学方程式为:BaCO3+2HCl=BaCl2+H2O+CO2↑.
故填:BaCO3+2HCl=BaCl2+H2O+CO2↑.
(2)沉淀C的主要成分是Ca(OH)2和Mg(OH)2.
故填:Mg(OH)2.
(3)图A、图B分别是氢氧化钙、氢氧化钡的溶解度曲线,据图分析可知,氢氧化钙的溶解度随着温度升高而减小,氢氧化钡的溶解度随着温度升高而增大,要使Ca2+更好沉淀,还应采取的措施为升高温度.
故填:升高温度.
(4)①若步骤 I称取的样品过少,则在步骤III洗涤时可能造成的影响为沉淀量少,洗涤造成的损耗大;
②步骤Ⅱ加入稀硫酸至反应完全的判断方法是:静置,取上层清液适量于试管中,滴入稀硫酸后不再有沉淀产生.
故填:沉淀量少,洗涤造成的损耗大;静置,取上层清液适量于试管中,滴入稀硫酸后不再有沉淀产生.
点评 本题主要考查物质的性质,只有掌握了各种物质的性质,才能够判断物质之间相互转化时的反应物和生成物,从而可以进行各方面的判断.

练习册系列答案
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案
相关题目
16.工业用盐亚硝酸钠(NaNO2)有毒,其外观与食盐极为相似,其氮元素的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
13. 乙二醇(ethylene glycol)又名“甘醇”,分子结构如图结构模型.乙二醇是无色无臭、有甜味液体,对动物有毒性,人类致死剂量约为1.6g/kg.乙二醇能与水互溶,是合成涤纶的原料.下列有关乙二醇的叙述错误的是( )
乙二醇(ethylene glycol)又名“甘醇”,分子结构如图结构模型.乙二醇是无色无臭、有甜味液体,对动物有毒性,人类致死剂量约为1.6g/kg.乙二醇能与水互溶,是合成涤纶的原料.下列有关乙二醇的叙述错误的是( )
 乙二醇(ethylene glycol)又名“甘醇”,分子结构如图结构模型.乙二醇是无色无臭、有甜味液体,对动物有毒性,人类致死剂量约为1.6g/kg.乙二醇能与水互溶,是合成涤纶的原料.下列有关乙二醇的叙述错误的是( )
乙二醇(ethylene glycol)又名“甘醇”,分子结构如图结构模型.乙二醇是无色无臭、有甜味液体,对动物有毒性,人类致死剂量约为1.6g/kg.乙二醇能与水互溶,是合成涤纶的原料.下列有关乙二醇的叙述错误的是( )| A. | 乙二醇的化学式为C2H602 | |
| B. | 乙二醇分子是由碳、氢、氧三种元素组成的 | |
| C. | 每个乙二醇分子中含有34个电子 | |
| D. | 乙二醇中碳、氢、氧三种元素的质量比为12:3:16 |
20. 甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
 甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )| A. | t2℃时,甲的溶解度与乙的溶解度相等 | |
| B. | t3℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数 | |
| C. | 浓的甲溶液中含有少量乙,可以采用加热浓缩后降温结晶的方法得到较纯净的甲晶体 | |
| D. | t1℃时,20g甲物质加入到80g水中,可以得到100g甲溶液 |
17.空气是人类宝贵的自然资源,下列有关空气的说法正确的是( )
| A. | 洁净的空气是纯净物 | |
| B. | 空气中的氧气可以供给呼吸、燃烧、炼钢、化工生产等 | |
| C. | 新鲜空气中不含二氧化碳 | |
| D. | 分离液态空气得到氧气和氮气的过程中发生了化学反应 |
15.在一密闭容器中,有甲、乙、丙、丁四种物质,一定条件下充分反应,测得反应前后各物质的质量如表:下列说法正确的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前的质量/g | 54 | 17 | 20 | 10 |
| 反应后的质量/g | 10 | 0 | 2 | x |
| A. | x为89 | B. | 参加反应的丙物质的质量为20g | ||
| C. | 该反应为分解反应 | D. | 甲物质全部反应完 |
 新华网东京4月10日电,截至当地时间当日19时,3月11日发生的日本大地震及其引发的海啸已确认造成13013人死亡、14608人失踪,给日本乃至全球的经济带来沉重打击.
新华网东京4月10日电,截至当地时间当日19时,3月11日发生的日本大地震及其引发的海啸已确认造成13013人死亡、14608人失踪,给日本乃至全球的经济带来沉重打击.