题目内容
6.在实验研究中,同学们对牙膏的成分和性质进行如下探究.(1)小红测定三种牙膏的pH.
甲:pH=8.5 乙:pH=7.0 丙:pH=6.5
能缓解牙齿酸痛的碱性牙膏是甲(填甲、乙或丙).
(2)小朋对某品牌牙膏中的摩擦剂成分及其含量进行测定.
【查阅资料】①该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
②牙膏中其它成分遇到盐酸时无气体产生.
【实验分析】根据以上资料,用如图所示装置测定牙膏样品中碳酸钙的含量
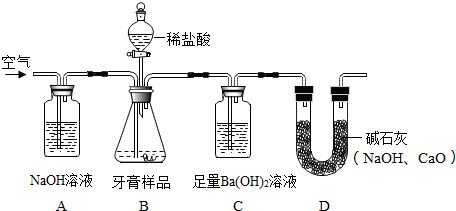
①装置A中氢氧化钠溶液的作用是吸收空气中的二氧化碳气体;
②装置C中观察到的现象是有沉淀产生;
③实验过程中需持续缓缓通入空气,其作用排出B装置中反应产生的二氧化碳气体,使其被C装置中的溶液充分吸收;
④装置D中碱石灰用于吸收空气中的二氧化碳和水蒸气,其中氧化钙与水反应的化学方程式为CaO+H2O═Ca(OH)2.
【定量计算】小朋称取10.0g牙膏样品,加入40g稀盐酸,恰好完全反应,装置C中生成沉淀的质量为1.97g.计算样品中碳酸钙的质量分数.
【反思与评价】有人认为不必测定C中沉淀的质量,只要测定装置C在反应前后的质量差,同样可以确定碳酸钙的质量分数.实验证明按此方法测定的结果偏高(偏高、不变或偏低),原因可能是吸收水蒸气或氯化氢气体.
分析 (1)根据溶液pH大于7时,显碱性,等于7时显中性,小于7时显酸性进行分析;
(2)【实验分析】①根据氢氧化钠溶液能够吸收二氧化碳气体进行分析;
②根据二氧化碳和氢氧化钡反应生成碳酸钡白色沉淀和水进行分析;
③为了使反应产生的二氧化碳全部被氢氧化钡溶液吸收,应该持续缓缓通入空气;
④根据氧化钙能和水反应生成氢氧化钙进行分析;
【定量计算】根据质量守恒定律计算生成的二氧化碳的质量,然后依据化学方程式计算参加反应的碳酸钙的质量,进而计算碳酸钙的质量分数;
【反思与评价】根据氢氧化钡会与氯化氢反应进行分析.
解答 解:(1)因为甲牙膏的pH大于7,显碱性,因此能缓解牙齿酸痛的碱性牙膏是甲;
(2)【实验分析】①该装置中氢氧化钠溶液的作用是吸收空气中的二氧化碳;
②C中观察到有沉淀产生,反应的化学方程式为:CO2+Ba(OH)2=BaCO3↓+H2O;
③实验过程中需持续缓缓通入空气,其作用是使反应产生的二氧化碳全部被氢氧化钡溶液吸收;
④氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O═Ca(OH)2;
【定量计算】设牙膏样品中碳酸钙质量为x
CO2+Ba(OH)2=BaCO3↓+H2O,CaCO3+2HCl=CaCl2+H2O+CO2↑
通过化学方程式可以看出
BaCO3------CaCO3,
197 100
1.97g x
$\frac{197}{1.97g}$=$\frac{100}{x}$
x=1g
样品中碳酸钙的质量分数为:$\frac{1g}{10g}$×100%=10%
答:样品中碳酸钙的质量分数为10%.
【反思与评价】实验证明按此方法测定的结果偏高,原因可能是:吸收水蒸气或氯化氢气体.
故答案为:(1)甲;
(2)【实验分析】①吸收空气中的二氧化碳;
②产生白色沉淀;
③使产生的二氧化碳气体完全被C中的氢氧化钡溶液吸收;
④CaO+H2O=Ca(OH)2;
【定量计算】样品中碳酸钙的质量分数为10%;
【数据分析】偏高,吸收水蒸气或氯化氢气体.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 用过滤的方法可以使硬水软化 | |
| B. | 用活性炭吸附水中的色素和异味是化学变化 | |
| C. | 水通电分解时产生的氢气和氧气质量比为2:1 | |
| D. | 可用肥皂水区分硬水与软水 |
| A. |  集气瓶 | B. |  坩埚钳 | C. |  塑料药匙 | D. |  石棉网 |
| A. | 氧气从无色气体变成淡蓝色液体,发生了化学变化 | |
| B. | 夏天鱼池内放增氧泵,是因为夏天温度高,氧气在水中溶解量较少 | |
| C. | 空气中氧气含量的测定实验中,可以将红磷换成木炭 | |
| D. | 氧气的化学性质比较活泼,是可燃物 |
| A. | 燃烧脱硫煤,有利于减少二氧化硫的排放 | |
| B. | 装修会造成室内污染,污染物之一是甲醛 | |
| C. | 工业酒精含有少量对人体有害的甲醇,因此绝对禁止用工业酒精配制饮用酒和调味用的酒 | |
| D. | 在猪肉中加入大量的牛肉膏(一种添加剂),让猪肉有牛肉的口感 |
| A. | 酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| B. | 碱中都含有氢氧根,所以碱中一定含有氢元素 | |
| C. | 酸能使紫色石蕊溶液变红,CO2通入紫色石蕊后溶液变红,所以CO2是酸 | |
| D. | 有机物都含碳元素,所以含碳元素的化合物都是有机物 |
| A. | 由3个元素组成 | B. | 相对分子质量为46g | ||
| C. | 碳、氢、氧元素质量比为12:3:8 | D. | 二甲醚是有机高分子化合物 |
 实验室用过量的稀盐酸和大理石制取CO2,取100g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如下图所示.回答下列问题:
实验室用过量的稀盐酸和大理石制取CO2,取100g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如下图所示.回答下列问题: