题目内容
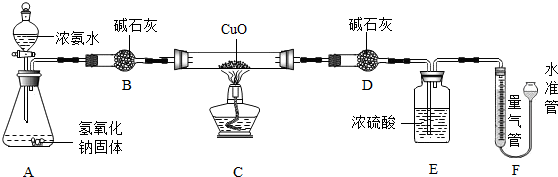
11.应用化学知识解释或解决问题:(1)国家新版《生活饮用水卫生标准》中规定,饮用水消毒剂除了目前采用的液氯以外,还补充了氯胺(NH2Cl)、臭氧(O3).NH2Cl消毒时,发生如下反应:
NH2Cl+H2O═X+HClO,其中X的化学式是NH3.
(2)氨水易挥发.其挥发性体现分子的什么特点?分子不断运动;检验氨水呈碱性的方法:取氨水少量于试管中,滴入酚酞试液,溶液变红色,说明氨水显碱性; ;可用硫酸溶液吸收氨气,发生化合反应生成一种氮肥.写出该反应的化学方程式:2NH3•H2O+H2SO4=(NH4)2SO4+4H2O .
(3)工业上常用赤铁矿(主要成分是Fe2O3)和一氧化碳在高温下炼铁,其反应的化学方程式:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.钢铁属于混合物(填“混合物”或“纯净物”);海沙不能代替河沙用于钢筋混凝土材料的原因是海沙盐分高,会出现氯离子腐蚀钢筋情况;有人将海沙倒入淡水河中冲洗后使用,该做法可能对环境造成的影响是会使河水盐分增加,破坏生态环境和生态系统.
分析 (1)根据质量守恒定律可知:反应前后元素种类不变,原子个数不变.由以上依据可推出X的化学式;
(2)氨水易挥发是因为氨分子是在不断的运动造成的;酚酞遇碱性溶液变红色;氨水和硫酸反应生成硫酸铵和水;
(3)根据反应物和生成物及其质量守恒定律可以书写化学方程式;由多种物质组成的物质属于混合物;海沙盐分高,会出现氯离子腐蚀钢筋情况;将海沙倒入淡水河中冲洗,会使河水盐分增加,破坏生态环境和生态系统.
解答 解:(1)根据所给化学方程式可以看出:化学方程式的右边比左边多出了1个氮原子3个氢原子;根据质量守恒定律中的元素种类不变和原子个数不变的特点,可知多出的原子全部来自1个X分子中,即X的化学式为NH3;
故填:NH3;
(2)氨水易挥发是因为氨分子是在不断的运动造成的;取氨水少量于试管中,滴入酚酞试液,溶液变红色,说明氨水显碱性;氨水和硫酸反应生成硫酸铵和水,化学方程式为:2NH3•H2O+H2SO4=(NH4)2SO4+4H2O;
故填:分子不断运动;取氨水少量于试管中,滴入酚酞试液,溶液变红色,说明氨水显碱性;2NH3•H2O+H2SO4=(NH4)2SO4+4H2O;
(3)一氧化碳与氧化铁在高温下反应的化学方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;铁中含碳量较高时,属于生铁,含碳量较低时,属于钢,钢铁属于混合物;海沙盐分高,会出现氯离子腐蚀钢筋情况;海沙倒入淡水河中冲洗,会使河水盐分增加,破坏生态环境和生态系统.
故填:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;混合物;海沙盐分高,会出现氯离子腐蚀钢筋情况;会使河水盐分增加,破坏生态环境和生态系统.
点评 本题考查内容较多,难度较大,需仔细分析.

 元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.
元素化合物知识是初中化学重要的学习内容.请回答下列有关元素化合物的问题.(1)根据如图信息,写出甲、乙两种元素的单质间发生反应的化学方程式:4Al+3O2=2Al2O3.
(2)某同学将铁片放入CuSO4溶液中,发现铁片表面有红色物质析出,同时还有少量无色无味气泡产生.对于产生气泡的“异常现象”,下列猜想不合理的是B(填字母).
A.产生的气体可能是H2 B.产生的气体可能是CO2
C.CuSO4溶液中可能含有少量的某种酸 D.CuSO4溶液的pH可能小于7
(3)某工厂用电解饱和食盐水的方法生产氯气、烧碱、氢气等化工产品(反应的化学方程式:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$2NaOH+H2↑+Cl2↑),这种工业称为“氯碱工业”.某研究性学习小组对该厂生产的烧碱样品进行如下研究.
【提出问题】烧碱样品中可能含有哪些杂质?
【猜想】
猜想一:可能含有Na2CO3.作出此猜想的依据是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示).
猜想二:可能含有NaCl.作出此猜想的依据是可能有少量的氯化钠没有反应(用简洁的文字表示).
【实验设计】
| 实验步骤 | 实验现象 | 解释或结论 |
| ①取适量烧碱样品置于试管中,加水溶解,并用手触摸试管外壁试 | 管外壁发热 | 原因是氢氧化钠固体溶于水放热 |
| ②向①所得的溶液中逐滴加入稀硝酸至过量 | 一开始无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠 |
| ③向②所得的溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还还有的杂质是氯化钠 |
| A. | 淀粉遇加碘食盐溶液会变蓝 | |
| B. | 瘦肉中主要含蛋白质,不含无机盐之类的营养素 | |
| C. | 某气体能使灼热的氧化铜还原成铜,这种气体一定是一氧化碳 | |
| D. | 鉴别氢氧化钠固体和硝酸铵固体,可加适量水溶解,用手触摸试管外壁温度的变化 |
| A. | 增加可燃物的浓度 | B. | 提高可燃物的着火点 | ||
| C. | 增加空气中氧气含量 | D. | 增大可燃物与空气的接触面 |
同学们发现该实验观察不到明显的现象,于是进行了一系列探究活动:
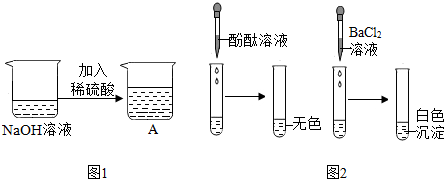
【提出问题】如何验证该反应已经发生?
【实验探究】甲组同学分别取图1所示A烧杯中的溶液进行了两个探究活动(实验1和实验2),现象如图2所示.
【反思评价】甲组同学认为图2中“实验1”能验证反应已经发生了,他们的理由是加入酚酞试液不变色.
【再次提问】图1所示A烧杯中溶液的溶质成分有哪些?
【再次探究】乙组同学进行如下实验,已知他们所加入试剂的类别不同于“实验1”和“实验2”所加试剂的类别.请填空:
| 实验操作 | 实验现象 | 结论 |
| 取A烧杯中的少量溶液于试管中,加入铁粉. | 观察到有气泡产生 | A烧杯中溶液的溶质是Na2SO4和H2SO4. |
将“实验2”中烧杯静置一段时间后,上层清液中一定有的溶质是NaCl.(填化学式)
探究一:A、B、C、D分别是纯碱、烧碱、氯化钠、硫酸钠中的一种,它们之间的转化关系如图1所示.
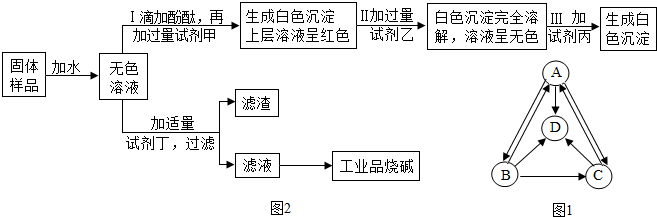
(1)四种物质中,属于碱的是NaOH(填化学式,下同).
(2)物质B是Na2CO3.
探究二:工业品烧碱含有少量氯化钠杂质.该小组同学从一瓶久置的工业品烧碱样品中取出一定量,在烧杯中加适量水溶解后得到样品溶液.用稀硫酸与样品溶液做中和反应实验.有关实验操作和现象如下:
| 实验步骤 | 实验现象 |
| Ⅰ.向样品溶液中滴加酚酞溶液 | 溶液呈红色 |
| Ⅱ.向样品溶液中滴加稀硫酸, 并用玻璃棒搅拌 | 滴加一定量稀硫酸后溶液中开始产生气泡 溶液仍呈红色 |
(3)样品溶液的pH>7(填写“<、=或>”).
(4)确认溶液里中和反应已经完成所依据的现象是滴加一定量稀硫酸后溶液中开始产生气泡.
最后,他们设计一个实验方案,验证了久置的工业品烧碱样品中确实含有氯化钠杂质且已经部分变质,并提纯工业品烧碱.其实验流程及部分实验现象如图2所示.
(5)试剂甲和试剂乙的溶液中阴离子都是NO3-(填离子符号).
(6)试剂丁是Ca(OH)2(填化学式).
(7)证明工业品烧碱样品已经部分变质的证据是操作中加过量Ba(NO3)2后生成白色沉淀,上层清液仍呈红色.