题目内容
5.下列说法不正确的是( )| A. | S02、CO、NO2都是造成空气污染的气体 | |
| B. | 喝汽水打嗝,是因为气体溶解度随温度升高而增大 | |
| C. | 燃烧需要同时满足三个条件,灭火只需要破坏至少一个条件即可 | |
| D. | 合金硬度一般比组成它的纯金属大 |
分析 A、根据空气的污染物分析;
B、根据气体溶解度的影响因素分析;
C、根据洗燃烧的条件分析;
D、合金的优点一般有强度好、熔点低、抗腐蚀性更好等.
解答 解:A、S02、CO、NO2都是造成空气污染的气体,正确;
B、喝汽水打嗝,是因为气体溶解度随温度升高而减小,错误;
C、燃烧需要同时满足三个条件,灭火只需要破坏至少一个条件即可,正确;
D、合金的硬度比组成它的纯金属的硬度大,多数合金硬度大于组成它的成分金属,正确;
故选:B.
点评 本题为基础性考察,性质不同因而用途也不相同,即性质决定用途.

练习册系列答案
相关题目
13.水是一切生命存在所必需的物质.下列关于水的叙述正确的是( )
| A. | 在水的净化过程中,蒸馏的净化程度最高 | |
| B. | 可用活性炭来区分硬水和软水 | |
| C. | 过滤操作可以除去水中的所以杂质 | |
| D. | 在水的电解实验中,正极产生的是氢气 |
13.某班同学按如图所示的实验探究质量守恒定律.

同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中,发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.该实验中,大家进行了两次称量,有四个小组得到下列数据:
其中有问题的两组数据是AD(填序号).进行两次称量的目的是判断反应是否遵循质量守恒定律
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是C(填序号).选择这套装置的原因是反应在密闭容器中进行
A.左盘高 B.右盘高 C.保持平衡
(3)在图2的锥形瓶中添加氢氧化钠的原因是吸收反应生成的二氧化碳,其发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.

同学们先按图1的方式实验,将盐酸加到碳酸钠粉末中,发生反应的化学方程式为Na2CO3+2HCl═2NaCl+H2O+CO2↑.该实验中,大家进行了两次称量,有四个小组得到下列数据:
| A | B | C | D | |
| 盐酸加入Na2CO3粉末前称量/g | 85.3 | 82.8 | 84.8 | 86.5 |
| 盐酸加入Na2CO3粉末后称量/g | 85.3 | 80.6 | 83.2 | 87.8 |
(2)同学们又按照图2的方式实验,当天平平衡后,挤压胶头滴管逐滴滴人盐酸,最终天平的状态是C(填序号).选择这套装置的原因是反应在密闭容器中进行
A.左盘高 B.右盘高 C.保持平衡
(3)在图2的锥形瓶中添加氢氧化钠的原因是吸收反应生成的二氧化碳,其发生反应的化学方程式为2NaOH+CO2═Na2CO3+H2O.
20.某兴趣小组的同学为了探究化学反应前后反应物与生成物之间的质量关系设计了如下三个实验:

实验甲:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验乙:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会再称量.(化学方程式是:Zn+2HCl=ZnCl2+H2↑)
实验丙:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触,过一会再称量.(化学方程式是:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4)
他们得到三次实验的数据如表:
(1)在实验甲中反应后的质量比反应前明显增加了,请解释原因:镁燃烧时,和空气中的氧气反应生成了氧化镁,因此氧化镁的质量大于反应的镁的质量.
(2)由上表中数据分析可知实验甲中参加反应的氧气质量为3.2g,实验乙中生成氢气的质量为0.2g.
(3)在上述三个实验中都遵循(填“遵循”或者“不遵循”)质量守恒定律,但只有实验丙正确反映了反应物与生成物之间的总质量关系,因此,用实验来探究化学反应前后反应物与生成物之间的总质量关系时,当有气体参加或生成时,必须在密闭容器中进行.
(4)请从分子、原子的角度解释反应前后质量相等的原因:反应前后原子的种类、总个数、质量都不变.
(5)在化学反应前后,肯定不会变化的是①③④.
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥物质的体积 ⑦物质的状态
(6)质量守恒定律这条结论的获得对化学研究的重大意义在于可以定量进行化学反应.

实验甲:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验乙:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会再称量.(化学方程式是:Zn+2HCl=ZnCl2+H2↑)
实验丙:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥形瓶口塞上橡皮塞,称量,然后设法将两种溶液接触,过一会再称量.(化学方程式是:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4)
他们得到三次实验的数据如表:
| 编号 | 实验甲 | 实验乙 | 实验丙 |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
(2)由上表中数据分析可知实验甲中参加反应的氧气质量为3.2g,实验乙中生成氢气的质量为0.2g.
(3)在上述三个实验中都遵循(填“遵循”或者“不遵循”)质量守恒定律,但只有实验丙正确反映了反应物与生成物之间的总质量关系,因此,用实验来探究化学反应前后反应物与生成物之间的总质量关系时,当有气体参加或生成时,必须在密闭容器中进行.
(4)请从分子、原子的角度解释反应前后质量相等的原因:反应前后原子的种类、总个数、质量都不变.
(5)在化学反应前后,肯定不会变化的是①③④.
①原子的数目 ②分子的数目 ③元素的种类 ④物质的质量总和 ⑤物质的种类 ⑥物质的体积 ⑦物质的状态
(6)质量守恒定律这条结论的获得对化学研究的重大意义在于可以定量进行化学反应.
10.小松同学在实验室发现一瓶久置在空气中的氢氧化钠固体,小松同学和他们小组同学探究这瓶固体变质程度,取样品13.5g于烧杯中,加入100g水使其完全溶解,逐渐加入一定质量分数的氯化钙溶液,实验数据如下:
( 1 ) 表中m的值3.0g;
(2)求样品中含氢氧化钠的质量分数?(保留到0.1%)
(3)反应前滴加氯化钙溶液的质量分数?
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 加入氯化钙溶液质量/g | 20.0 | 60.0 | 80.0 |
| 生成沉淀质量/g | 1.0 | m | 3.5 |
(2)求样品中含氢氧化钠的质量分数?(保留到0.1%)
(3)反应前滴加氯化钙溶液的质量分数?
17.下列数据是硝酸钾和氯化钠在不同温度时的溶解度.
(1)30℃时,向l00g水中加入45.8g硝酸钾,充分溶解后得到饱和(选填“饱和”或“不饱和”)溶液.
(2)从NaCl溶液中得到NaCl晶体的方法是蒸发溶剂.
(3)从表中数据看,40℃时,氯化钠的溶解度与硝酸钾的溶解度相比更小(填“无法确定”“更大”“更小”).
(4)如图所示,小烧杯中盛放的是上述(1)中所得的硝酸钾溶液.若将少量的下列物质,分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是AC(填字母).
A.冰 B.浓硫酸 C.硝酸铵 D.氢氧化钠.

| 温度/℃ | 10 | 30 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 35.8 | 36.3 | 37.0 | 37.3 |
| 硝酸钾 | 20.9 | 45.8 | 85.5 | 110 | |
(2)从NaCl溶液中得到NaCl晶体的方法是蒸发溶剂.
(3)从表中数据看,40℃时,氯化钠的溶解度与硝酸钾的溶解度相比更小(填“无法确定”“更大”“更小”).
(4)如图所示,小烧杯中盛放的是上述(1)中所得的硝酸钾溶液.若将少量的下列物质,分别小心地加入到大烧杯的水中,不断搅拌,一定能够使小烧杯中有固体析出的是AC(填字母).
A.冰 B.浓硫酸 C.硝酸铵 D.氢氧化钠.
14.下列四个图象中有关量的变动趋势与对应的叙述关系中正确的是( )
| A. | 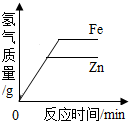 表示等质量的锌和铁分别与足量溶质质量分数相同的稀硫酸反应 | |
| B. | 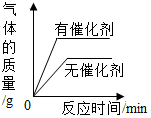 表示完全相同的两份过氧化氢溶液在有、无催化剂条件下的分解 | |
| C. | 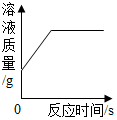 表示向一定量硫酸铜溶液中加入一定量锌粉 | |
| D. | 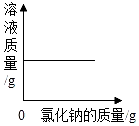 表示向一定量的饱和氯化钠溶液中加入硝酸钾固体 |
15.下列实验操作正确的是( )
| A. |  倾倒液体 | B. |  加热液体 | C. |  量取液体 | D. |  滴加液体 |
 A~I为初中化学中常见物质.已知A为金属氧化物,C为白色沉淀,D为蓝色沉淀,甲为锌粉和铁粉的混合物.(部分生成物末标出),它们之间的关系如图所示.请回答下列问题:
A~I为初中化学中常见物质.已知A为金属氧化物,C为白色沉淀,D为蓝色沉淀,甲为锌粉和铁粉的混合物.(部分生成物末标出),它们之间的关系如图所示.请回答下列问题: