题目内容
17.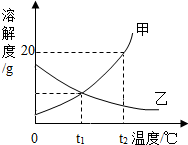 如图是甲、乙两种固体物质的溶解度曲线,回答:
如图是甲、乙两种固体物质的溶解度曲线,回答:(1)t1℃时,甲、乙两曲线交点的含义是t1℃时,甲、乙两物质的溶解度相同.
(2)t2℃时,甲的饱和溶液变为不饱和溶液可采用的方法是升高温度(或增加溶剂)(答出一种即可).
(3)t2℃时,将25g甲放入100g水中,所得溶液中溶质和溶剂的质量比为1:5.
(4)下列说法正确的是C.
A、甲中含有少量的乙可采用蒸发结晶的方法提纯甲
B、t2℃时,甲溶液溶质的溶质质量分数比乙溶液大
C、t2℃时,将等质量的甲乙两物质分别加水配制成饱和溶液,甲溶液质量比乙溶液质量小
D、将t1℃甲乙饱和溶液的升温至t2℃时,甲乙溶液的溶质质量分数都不变.
分析 (1)溶解度曲线的交点表示该温度下两物质的溶解度相等;
(2)饱和溶液变为不饱和溶液的方法有加入溶剂、升高温度;
(3)根据该温度下甲的溶解度分析解答;
(4)据物质溶解度随温度变化可判断提纯物质的方法,并明确饱和溶液中溶质的质量质量分数的计算式$\frac{溶解度}{溶解度+100g}$×100%,进而分析温度变化溶质的质量分数变化情况.
解答 解:(1)t1℃时,甲、乙两物质的溶解度曲线相交于一点,二者的溶解度相同;
(2)甲的溶解度随温度升高而增大,所以在t2℃甲的饱和溶液变为不饱和溶液,可采用的方法是升高温度(或增加溶剂);
(3)t2℃时甲的溶解度是20g,即100g水中最多溶解20g的甲,所以将25g甲放入100g水中最多溶解20g,所得溶液中溶质和溶剂的质量比为20g:100g=1:5;
(4)A、甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减小,所以甲中含有少量的乙可采用降温结晶的方法提纯甲,故错误;
B、t2℃时,不知溶液中溶质、溶剂的质量,所以无法判断溶液中溶质的质量分数大小,故错误;
C、t2℃时甲的溶解度大于乙的溶解度,所以将等质量的甲乙两物质分别加水配成饱和溶液,需要水的质量乙比甲多,所以甲溶液质量比乙溶液质量小,正确;
D、由于甲的溶解度随温度升高而增大,乙的溶解度随温度升高而减小,所以将t1℃甲乙的饱和溶液升温至t2℃时,甲溶液的溶质质量分数不变,乙析出晶体,溶质的质量减小,则溶质的质量分数减小,故错误;
故答案为:(1)t1℃时,甲、乙两物质的溶解度相同;
(2)升高温度(或增加溶剂);
(3)1:5;
(4)C.
点评 本题主要考查了固体溶解度曲线所表示的意义及根据固体溶解度曲线解决相关的问题,从而培养学生对知识的应用能力.

 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案| A. | 酒精和水 | B. | 食盐水和细沙 | C. | 铁粉和铜粉 | D. | 食盐和水 |
| A. | 氢氧化钠溶液、稀盐酸 | B. | 氮气、氢气 | ||
| C. | 硝酸钡溶液、稀硫酸 | D. | 银、硝酸锌溶液 |
(1)检验该气体是否为氧气的方法是将带火星的木条伸入瓶中,若木条能复燃,说明是氧气.
(2)若用如图2的装置来收集干燥的氧气,氧气应从②进入.(填①或②)
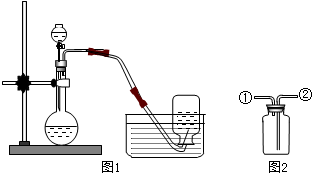
(3)实验之后,该同学展开探究:催化剂二氧化锰的用量对反应速率有怎样的影响?他做了这样一组实验,每次均用30毫升10%的H2O2溶液,使用不同量的二氧化锰粉末做催化剂,测定每次收集700毫升氧气所用的时间,结果如下:
| 实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| 二氧化锰粉末用量(克) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
| 所用时间(秒) | 17 | 8 | 7 | 5 | 4 | 3 | 2 | 2 | 2 | 2 |
(4)如果在实验中忘了加入二氧化锰,下列对实验结果的描述正确的是C.
A、不影响化学反应速率 B、氧气总量不变,但是反应速率慢
C、氧气总量变少,且反应速率慢 D、无法产生氧气
(5)若实验室要制取1.6克氧气,理论上需要多少克溶质质量分数为10%的过氧化氢溶液?
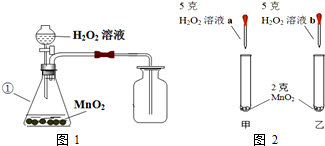
(1)写出编号为①的仪器名称:锥形瓶.
(2)某同学根据图2进行实验,观察到甲试管中产生气泡比乙试管中产生气泡多.你认为原因是a溶液比b溶液浓.
(3)20℃,市售的双氧水的浓度为10%,其中溶质和溶剂的质量比为1:9.取市售的20mL质量分数为10%的双氧水,加一定质量的水稀释成3%的双氧水.从如表中找出配制过程中需要用到的数据:1.024g/mL.最终可稀释得到68.3克3%的双氧水.(保留至0.01%)
| 溶质质量分数 | 10% | 3% |
| 密度(单位g/mL) | 1.024 | 0.991 |
①反应中生成氧气的质量为0.8g.
②根据化学方程式,计算该双氧水中溶质H2O2的质量.
③该双氧水的溶质质量分数为5%.

 如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题:
如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题: