题目内容
9. 如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题:
如图表示硝酸钾和氯化钠的溶解度曲线.请根据图回答下列问题:①在20℃时,氯化钠的溶解度较大.
②在t1℃时,分别取两杯100mL水,各加入40g硝酸钾、氯化钠分别配成饱和溶液(填“饱和”或“不饱和”),继续将温度都升至t2℃时,分别的现象是:剩余的硝酸钾全部溶解,剩余的氯化钠几乎没有变化.
③若要从混有少量硝酸钾的氯化钠固体中分离出氯化钠晶体,采用的操作有:溶解、蒸发结晶、过滤.
分析 ①根据某一温度时物质溶解度的比较方法解答;
②根据t1℃时二者的 溶解度相等和t2℃时硝酸钾和氯化钠的溶解度大小解答;
③根据固体物质从溶液中结晶析出的方法,及氯化钠和硝酸钾的溶解度随温度变化情况解答.
解答 解:①从20℃向上做垂线,与曲线的交点在上面的溶解度就大,所以20℃时氯化钠的溶解度较大;
②在t1℃时氯化钠和硝酸钾的溶解度均小于40g,即100g水中最多溶解溶质的质量均小于40g,所以分别取两杯100mL水,各加入40g硝酸钾、氯化钠分别配成饱和溶液,t2℃时硝酸钾的溶解度大于40g,氯化钠的溶解度小于40g,且与升温前几乎相等,所以升温至t2℃时,硝酸钾将全部溶解,而剩余的氯化钠几乎没有变化;
③如果溶解度受温度影响较大的物质从溶液中结晶析出的方法是冷却热饱和溶液,如果溶解度受温度影响不大的物质从溶液中结晶析出的方法是蒸发溶剂.硝酸钾固体的溶解度随温度的升高明显增大,氯化钠固体的溶解度受温度变化影响较小,所以要从混有少量硝酸钾的氯化钠固体中分离出氯化钠晶体,可先溶解,然后蒸发溶剂,氯化钠结晶析出,然后过滤得到氯化钠;
故答案为:①氯化钠;
②饱和;剩余的硝酸钾全部溶解,剩余的氯化钠几乎没有变化;
③溶解、蒸发结晶、过滤.
点评 解答本题关键是要知道一定温度下物质溶解度大小的比较方法,溶解度的含义,并知道物质从溶液中析出的方法和影响因素.

练习册系列答案
相关题目
4.下列实验操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
14.下列做法不会对环境产生影响的是( )
| A. | 用氢气做燃料 | B. | 用煤做燃料 | C. | 乱扔垃圾 | D. | 露天焚烧秸秆 |
1.除去下列物质中的少量杂质,所选方法正确的是( )
| 选项 | 物质 | 杂质 | 除杂试剂和方法 |
| A | CO2 | HCl | 通过氧化钠溶液 |
| B | KCl固体 | KClO3固体 | 加入少量MnO2加热 |
| C | NaCl | Na2CO3 | 加足量的稀盐酸 蒸发结晶 |
| D | CaO | CaCO3 | 加足量的稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
18.氧气是空气的主要成分之一,有关氧气说法正确的是( )
| A. | 用带火星的木条可以检验氧气的存在 | |
| B. | 氧气约占空气质量的$\frac{1}{5}$ | |
| C. | 鱼类能在水中生活,证明氧气易溶于水 | |
| D. | 燃着的木条能在氧气中激烈燃烧,说明氧气具有可燃性 |
19.已知CaCO3+H2O+CO2═Ca(HCO3)2,Ca(HCO3)2可溶于水.下列图象不能正确反映其对应变化关系的是
( )
( )
| A. |  用等质量、等浓度的过氧化氢溶液在有无催化剂条件下制氧气 | |
| B. |  向等质量、等浓度的稀硫酸中分别逐渐加入锌粉和铁粉 | |
| C. |  向一定质量的氯化铜和稀盐酸的混合溶液中逐滴加入氢氧化钠溶液 | |
| D. |  表示澄清石灰水中持续通入CO2 |
 人胃酸(主要成分是盐酸)过多,会引起很胃病.如图为某抗酸药包装标签上的部分文字,请回答下列问题.
人胃酸(主要成分是盐酸)过多,会引起很胃病.如图为某抗酸药包装标签上的部分文字,请回答下列问题.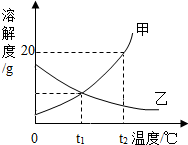 如图是甲、乙两种固体物质的溶解度曲线,回答:
如图是甲、乙两种固体物质的溶解度曲线,回答: