题目内容
13.如图1是“XX牌贴身暖宝宝”使用说明书,小王等同学阅读了使用说明后,对它的成分和发热原理产生了兴趣,和同学们一起进行了实验探究.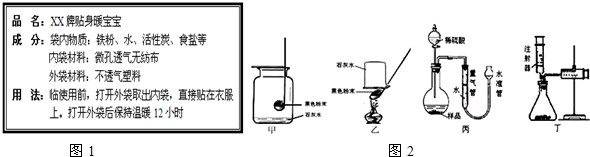
(1)袋内物质中含有的金属元素至少有2种,其外袋材料属于合成(填“无机非金属”、“合成”或“复合”)材料.
(2)初步探究成分及发热原理
【提出问题】:“暖宝宝”为什么能发热?
【做出猜想】:“暖宝宝”发出的热量主要来自铁粉氧化(即生锈)的过程.
【设计实验】:
| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,将A袋按使用说明打开外袋取出内袋;而B袋不打开外袋.并将两袋样品放置在同样的环境中. | A袋的“暖宝宝”温度很快上升;B袋温度无明显变化. | “暖宝宝”发热是由于袋内物质与O2接触. |
| 步骤2 | 24小时后,分别剪开A、B两袋,各取少量袋内物质于两支试管中,分别加入适量稀盐酸. | A袋内物质部分溶解,产生黄色溶液;B袋内物质部分溶解,有气泡产生,浅绿色溶液. | 用化学方程式表示产生黄色溶液的反应: Fe2O3+6HCl=2FeCl3+3H2O |
| 得出结论:“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程. | |||
同学们分析铁生锈是一个缓慢氧化的过程,“暖宝宝”放热现象之所以很明显是因为:①铁呈粉末状,活性炭有吸附性,使铁能与氧气、水等接触充分;②氯化钠能加快铁生锈;
(3)测定“暖宝宝”中的含铁量
取一片包装完好的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【实验方法】:取样品m g,利用如图丙所示装置与药品,测反应后生成气体的体积.
【实验步骤】:
①连接仪器,检查装置气密性;
②将实验所用药品装入各仪器中,记录量气管(水准管中水不会溢出)初始刻度;
③打开分液漏斗活塞,加入足量稀硫酸至不再有气泡冒出.在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移(填“上提”或“下移”).
④等恢复至室温,并调节量气管与水准管两边液面相平后,再次记录量气管刻度;
【数据处理】:
若实验条件下,氢气的密度为d g/mL,测得氢气体积为v mL.则该“暖宝宝”中铁粉的质量分数的表达式为$\frac{28dv}{m}$×100%.
【交流讨论】:利用丙装置,即使操作无失误,测量结果仍会偏大,原因是滴入烧瓶内的稀硫酸占一定体积,小王重新设计了一个如图丁的实验装置,利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀硫酸体积为V1mL,充分反应后,右侧针筒中气体的读数为V2 mL,则反应生成的氢气的体积为V2-V1 mL.
(4)测定“暖宝宝”中的铁、碳质量比
小李取了一片外袋已有部分破损的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【查阅资料】:
①2Fe(OH)3═Fe2O3+3H2O;②Fe+2FeCl3═3FeCl2;③在HCl和FeCl3的混合溶液中Fe先与FeCl3反应
【实验记录】:
【实验结论】:经该实验测定,新产品的配料中碳粉和铁粉的质量比为1.9:7.28,该片已有破损的“暖宝宝”中的剩余铁单质的质量为6.16 g.
分析 (1)根据暖宝袋内成分的组成元素分析;根据塑料制品属于合成材料分析;
(2)铁在与氧气和水充分接触时容易发生化学反应,反应过程中放出热量,从而使得“暖宝宝”为人体提供热量.铁在只有水没有氧气存在的情况下不容易生锈.根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.保存“暖宝宝”取暖贴时不要使外袋破损,保持包装的气密性,以防失效.
【继续探究】根据铁的性质分析,根据实验的干扰因素分析,从排除干扰的方面解答;
①根据活性炭的用途分析;
②根据促进铁生锈的因素分析;
(3)①根据制取气体的注意事项分析;
③④根据连通器的原理分析;
【数据处理】
根据氢气的体积可求出氢气的质量,根据氢气的质量,通过化学方程式的计算求铁的质量,进一步可求出铁的质量分数;
【交流讨论】
根据实验中的操作及反应原理分析;
(4)【实验结论】根据氧化铁的质量可求出铁的质量,黑色悬浮物为碳粉;求出与氯化铁反应的单质铁的质量加上生成0.2g氢气的质量即可.
解答 解:(1)由袋内物质含有铁粉和食盐可知贴身暖宝宝袋内物质中含有的金属元素为铁元素和钠元素;贴身暖宝宝外袋材料为不透气塑料,塑料属于有机合成材料;
(2)【设计实验】
A袋中的物质与空气接触,只有铁常温能与氧气反应放出热量,生成铁锈(主要成分是Fe2O3),Fe2O3与稀盐酸反应生成氯化铁和水,氯化铁的溶液呈黄色;B袋没有打开外袋,铁粉没有与氧气接触,不能发生缓慢氧化,故温度无明显变化,加入盐酸,铁与稀盐酸反应生成氯化亚铁和氢气,氯化亚铁的溶液呈浅绿色.
【继续探究】根据铁与盐酸反应,活性炭和盐酸不反应的原理,加入过量的稀盐酸除去铁粉;根据活性炭燃烧的产物是二氧化碳,可用澄清的石灰水检验二氧化碳的产生,乙图中酒精燃烧也会产生二氧化碳会干扰实验结果,故甲装置图得出的结论更可靠;
①利用活性炭的吸附性可吸收空气中的氧气和水;
②氯化钠也是促进铁粉生锈的因素之一;
(3)①实验开始前必须先检查装置的气密性;
③在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移,减小烧瓶和量气管内的压强;
④根据连通器的原理可以知道,为了使实验结果准确,应该移动调节水准管和量气管中的液面相平后才能读数;
【数据处理】
解:设铁粉的质量为X
Fe+2HCl=FeCl2+H2↑
56 2
X dv
$\frac{56}{2}$=$\frac{2}{dv}$
解得:X=28dv
铁的质量分数为:$\frac{28dv}{m}$×100%
【交流讨论】
丙装置加入的硫酸占据了一定的空间,使测得的气体的体积偏大,从而使得测定结果偏高;使用丁装置产生气体的体积应该等于注射器内气体的体积减去滴加的硫酸的体积;
(4)【实验结论】根据反应流程可知碳粉的质量为1.9g,铁粉的质量为:10.4g×$\frac{112}{160}$×100%=7.28g 碳粉和铁粉的质量比为:1.9g:7.28g=95:364;
解:设生成0.2g氢气参加反应铁粉的质量为x
Fe+2HCl=FeCl2+H2↑
56 2
X 0.2g
$\frac{56}{X}$=$\frac{2}{0.2g}$
x=5.6g
则剩余铁元素的质量为7.28g-5.6g=1.68g,这1.68g的铁元素发生了以下反应Fe+2FeCl3=3FeCl2
即铁单质与氯化铁中铁元素的质量比是1:2,则参加反应铁单质的质量为1.68g×$\frac{1}{3}$=0.56g,则破损的“暖宝宝”中的剩余铁单质的质量为5.6g+0.56g=6.16g;
故答案为:
(1)2 合成
(2)无明显变化 O2 (或空气) 部分溶解,有气泡产生,浅绿色溶液
Fe2O3+6HCl=2FeCl3+3H2O
稀盐酸 甲 乙方案酒精燃烧生成的CO2会干扰实验 吸附 氯化钠能加快铁生锈
(3)检查装置气密性 下移 调节量气管与水准管两边液面相平;$\frac{28dv}{m}$×100%
滴入烧瓶内的稀硫酸占一定体积 V2-V1
(4)1.9:7.28 (或95:364)6.16 g
点评 典型联系生活实际的问题,考查的知识点清晰,注重了知识点之间的链接.

 名校课堂系列答案
名校课堂系列答案| A. | Na2SO4 BaCl2 NaCl KNO3 | B. | HCl Na2CO3 BaCl2 KNO3 | ||
| C. | NaOH FeCl2 Na2SO4 BaCl2 | D. | NaNO3 CuCl2 AgNO3 HNO3 |
| A. | 矿泉水 | B. | 冰水混合物 | C. | 雨水 | D. | 自来水 |
| A. | 利用稀盐酸可以区别石头纸与木浆纸 | |
| B. | 石头纸的应用不能减少对树木的砍伐 | |
| C. | 聚乙烯是一种天然有机高分子材料 | |
| D. | 石头纸极易溶于水并可以回收利用 |
(1)用化学用语填空.
| 2个氧原子 | 4个水分子 | 5个亚铁离子 | 6个铵根离子 |
| 2H | 4H2O | 5Fe2+ | 6N${{H}_{4}}^{+}$ |
①请用甲烷、氯化钠、熟石灰、小苏打、硫酸的化学式填入下表相应的空格中.
| 用途 | 用于除去铁锈 | 天然气的主要成分 | 作为调味品 | 用于改良酸性土壤 | 烹制糕点所用发酵粉的主要成分化学式 |
| 化学式 | H2SO4 | CH4 | NaCl | Ca(OH)2 | NaHCO3 |
A.煤气中毒是由一氧化碳气体引起的
B.农药“波尔多液”由硫酸铜、生石灰和水配制而成,配制时能用铁制容器
C.炉具清洁剂中含有氢氧化钠
D.小麦出现倒伏现象,可施氮肥
(3)化学源于生活,生活中蕴含着许多化学知识.
①打开盛装白醋的瓶盖,较远处也能闻到酸味,这是由于白醋分子具有不断运动的性质.向白醋中加入紫色石蕊溶液,溶液变红色.
②洗洁精能去油污,利用洗洁精的乳化作用.
③野炊后用沙土盖灭火种的主要灭火原理是隔绝氧气.
④牛奶中富含的营养素是蛋白质.牛奶可用聚乙烯塑料袋盛装,聚乙烯塑料是合成(填“天然”或“合成”)有机高分子材料.
| 序号 | 溶液中检验出的物质 |
| 1 | KCl、K2SO4、Na2CO3 |
| 2 | Na2SO4、BaCl2、K2CO3 |
| 3 | Na2SO4、KCl、K2CO3 |
(1)表中第2次结果肯定不准确.
(2)为验证其他两次检验结果中是否存在SO42-、CO32-和Cl-,又进行以下操作:①加入过量的稀硝酸;②加入Ba(NO3)2溶液,过滤;③向滤液中加入AgNO3溶液.
| A. |  倾倒液体 | B. |  称量氢氧化钠 | C. |  氧气验满 | D. |  读取液体体积 |
 某化学兴趣小组利用如图所示装置探究两个实验.
某化学兴趣小组利用如图所示装置探究两个实验.