题目内容
2.某校化学兴趣小组在课外活动中,对某溶液进行了多次检验,其中3次检验的结果如表所示.| 序号 | 溶液中检验出的物质 |
| 1 | KCl、K2SO4、Na2CO3 |
| 2 | Na2SO4、BaCl2、K2CO3 |
| 3 | Na2SO4、KCl、K2CO3 |
(1)表中第2次结果肯定不准确.
(2)为验证其他两次检验结果中是否存在SO42-、CO32-和Cl-,又进行以下操作:①加入过量的稀硝酸;②加入Ba(NO3)2溶液,过滤;③向滤液中加入AgNO3溶液.
分析 (1)根据复分解反应的条件分析物质能否共存;
(2)要证明同一溶液中含有碳酸根离子、硫酸根离子和氯离子,应先加入足量稀硝酸,验证碳酸根离子,然后加入硝酸钡溶液证明硫酸根离子,加入硝酸银溶液证明氯离子.
解答 解:(1)因为氯化钡和碳酸钠、硫酸钾都能够反应产生沉淀而不能共存于同一溶液中,其它两组物质间互不反应,可以共存;故答案为:2;
(2)要验证出原无色溶液中含有碳酸根离子、硫酸根离子和氯离子,可取少量无色废液于试管中,加入过量的稀硝酸,既能够验证碳酸根离子的存在又能够把碳酸根离子反应掉,防止对硫酸根离子和氯离子的干扰然后加入过量(或足量)的Ba(NO3)2的溶液,产生白色沉淀,说明含有硫酸根离子,过滤,向滤液中加入少量的AgNO3溶液,有白色沉淀产生,说明含有氯离子;但不能先加硝酸银,因为硫酸根离子与硝酸银反应生成的硫酸银微溶,不能证明是否含有氯离子.
故答案为:Ba(NO3)2;AgNO3.
点评 在确定溶液的组成时,首先要保证所确定的溶液中的溶质必须保证能在同一溶液中共存,也就是所确定的溶质不能发生化学反应,在检验硫酸根离子和氯离子时,通常先检验硫酸根离子,排除硫酸银微溶性物质的干扰.

练习册系列答案
相关题目
13.如图1是“XX牌贴身暖宝宝”使用说明书,小王等同学阅读了使用说明后,对它的成分和发热原理产生了兴趣,和同学们一起进行了实验探究.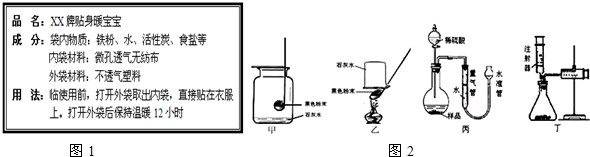
(1)袋内物质中含有的金属元素至少有2种,其外袋材料属于合成(填“无机非金属”、“合成”或“复合”)材料.
(2)初步探究成分及发热原理
【提出问题】:“暖宝宝”为什么能发热?
【做出猜想】:“暖宝宝”发出的热量主要来自铁粉氧化(即生锈)的过程.
【设计实验】:
【继续探究】:小王和同学们想继续探究“暖宝宝”发热后,剩余物质中是否还含有活性炭,他们取适量A袋内物质于烧杯内,加入过量稀盐酸,充分反应后过滤,洗涤、烘干滤渣.为进一步验证黑色滤渣的成分,小王和小李同学分别设计了甲、乙两个如图2所示的装置,点燃滤渣,用澄清石灰水验证产物,你认为甲图的装置结论更可靠,理由是乙方案酒精燃烧生成的CO2会干扰实验.
同学们分析铁生锈是一个缓慢氧化的过程,“暖宝宝”放热现象之所以很明显是因为:①铁呈粉末状,活性炭有吸附性,使铁能与氧气、水等接触充分;②氯化钠能加快铁生锈;
(3)测定“暖宝宝”中的含铁量
取一片包装完好的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【实验方法】:取样品m g,利用如图丙所示装置与药品,测反应后生成气体的体积.
【实验步骤】:
①连接仪器,检查装置气密性;
②将实验所用药品装入各仪器中,记录量气管(水准管中水不会溢出)初始刻度;
③打开分液漏斗活塞,加入足量稀硫酸至不再有气泡冒出.在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移(填“上提”或“下移”).
④等恢复至室温,并调节量气管与水准管两边液面相平后,再次记录量气管刻度;
【数据处理】:
若实验条件下,氢气的密度为d g/mL,测得氢气体积为v mL.则该“暖宝宝”中铁粉的质量分数的表达式为$\frac{28dv}{m}$×100%.
【交流讨论】:利用丙装置,即使操作无失误,测量结果仍会偏大,原因是滴入烧瓶内的稀硫酸占一定体积,小王重新设计了一个如图丁的实验装置,利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀硫酸体积为V1mL,充分反应后,右侧针筒中气体的读数为V2 mL,则反应生成的氢气的体积为V2-V1 mL.
(4)测定“暖宝宝”中的铁、碳质量比
小李取了一片外袋已有部分破损的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【查阅资料】:
①2Fe(OH)3═Fe2O3+3H2O;②Fe+2FeCl3═3FeCl2;③在HCl和FeCl3的混合溶液中Fe先与FeCl3反应
【实验记录】:
【实验结论】:经该实验测定,新产品的配料中碳粉和铁粉的质量比为1.9:7.28,该片已有破损的“暖宝宝”中的剩余铁单质的质量为6.16 g.

(1)袋内物质中含有的金属元素至少有2种,其外袋材料属于合成(填“无机非金属”、“合成”或“复合”)材料.
(2)初步探究成分及发热原理
【提出问题】:“暖宝宝”为什么能发热?
【做出猜想】:“暖宝宝”发出的热量主要来自铁粉氧化(即生锈)的过程.
【设计实验】:
| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,将A袋按使用说明打开外袋取出内袋;而B袋不打开外袋.并将两袋样品放置在同样的环境中. | A袋的“暖宝宝”温度很快上升;B袋温度无明显变化. | “暖宝宝”发热是由于袋内物质与O2接触. |
| 步骤2 | 24小时后,分别剪开A、B两袋,各取少量袋内物质于两支试管中,分别加入适量稀盐酸. | A袋内物质部分溶解,产生黄色溶液;B袋内物质部分溶解,有气泡产生,浅绿色溶液. | 用化学方程式表示产生黄色溶液的反应: Fe2O3+6HCl=2FeCl3+3H2O |
| 得出结论:“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程. | |||
同学们分析铁生锈是一个缓慢氧化的过程,“暖宝宝”放热现象之所以很明显是因为:①铁呈粉末状,活性炭有吸附性,使铁能与氧气、水等接触充分;②氯化钠能加快铁生锈;
(3)测定“暖宝宝”中的含铁量
取一片包装完好的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【实验方法】:取样品m g,利用如图丙所示装置与药品,测反应后生成气体的体积.
【实验步骤】:
①连接仪器,检查装置气密性;
②将实验所用药品装入各仪器中,记录量气管(水准管中水不会溢出)初始刻度;
③打开分液漏斗活塞,加入足量稀硫酸至不再有气泡冒出.在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移(填“上提”或“下移”).
④等恢复至室温,并调节量气管与水准管两边液面相平后,再次记录量气管刻度;
【数据处理】:
若实验条件下,氢气的密度为d g/mL,测得氢气体积为v mL.则该“暖宝宝”中铁粉的质量分数的表达式为$\frac{28dv}{m}$×100%.
【交流讨论】:利用丙装置,即使操作无失误,测量结果仍会偏大,原因是滴入烧瓶内的稀硫酸占一定体积,小王重新设计了一个如图丁的实验装置,利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀硫酸体积为V1mL,充分反应后,右侧针筒中气体的读数为V2 mL,则反应生成的氢气的体积为V2-V1 mL.
(4)测定“暖宝宝”中的铁、碳质量比
小李取了一片外袋已有部分破损的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【查阅资料】:
①2Fe(OH)3═Fe2O3+3H2O;②Fe+2FeCl3═3FeCl2;③在HCl和FeCl3的混合溶液中Fe先与FeCl3反应
【实验记录】:
【实验结论】:经该实验测定,新产品的配料中碳粉和铁粉的质量比为1.9:7.28,该片已有破损的“暖宝宝”中的剩余铁单质的质量为6.16 g.
10.某工厂的原料Fe2O3(粉末状)中混入了铜粉,现要测定混合物中的铜粉质量分数可用多种方法,请按照测定步骤依次选择下列所示的实验步骤(填编号字母),再列举两种不同的方法.提供可选择的实验操作步骤是:(可重复选用)
A.用天平称取混合物W克
B.在空气中充分加热W克混合物
C.将混合物W克加到足量的氯化锌溶液中
D.将混合物W克加到足量的硝酸银溶液中
E.小心过滤
F.在高温加热W克混合物的条件下通入充足的CO
G.根据混合物反应前后的质量变化进行计算
H.用天平称量加热冷却后的混合物质量
I.用天平称量洗涤、干燥后的滤出物质量
A.用天平称取混合物W克
B.在空气中充分加热W克混合物
C.将混合物W克加到足量的氯化锌溶液中
D.将混合物W克加到足量的硝酸银溶液中
E.小心过滤
F.在高温加热W克混合物的条件下通入充足的CO
G.根据混合物反应前后的质量变化进行计算
H.用天平称量加热冷却后的混合物质量
I.用天平称量洗涤、干燥后的滤出物质量
| 方法 | 实验步骤依次编号 | 方程式 |
| 例: | A、B、H、G | Fe2O3+3H2SO4═Fe2(SO4)3+3H2O |
| 方法一 | ||
| 方法二 |
17.1869年,俄国科学家门捷列夫对已发现60多种元素的性质进行了研究.当元素按照相对原子质量递增的顺序排列时,同列或同行元素的密度呈现规律性的变化,元素的相对原子质量与相邻(同列、同行)元素的相对原子质量也存在一定的关系.据此他预测了当时还未被发现元素的某些性质并被后来的实验所证明:
部分元素的相对原子质量和密度表
(1)由表中同列元素数据变化可得出:随着元素相对原子质量增大,元素的密度增大;
(2)现有未知元素X与硅和锡处于同一列且位于两者之间,与镓和砷处于同一行且位于两者之间,则未知元素X的相对原子质量约为73.
部分元素的相对原子质量和密度表
| 元素关系 | 同列元素 | 未知元素X的相邻元素 | |||||
| 元素名称 | 钙 | 锶 | 钡 | 硅 | 镓 | 砷 | 锡 |
| 相对原子质量 | 40 | 88 | 137 | 28 | 70 | 75 | 119 |
| 密度(克/厘米3) | 1.55 | 2.60 | 3.62 | 2.40 | 5.89 | 5.72 | 7.30 |
(2)现有未知元素X与硅和锡处于同一列且位于两者之间,与镓和砷处于同一行且位于两者之间,则未知元素X的相对原子质量约为73.
7.下列各组内物质的溶液混合后,所得溶液一定呈碱性的是( )
| A. | KOH、Na2CO3、HCl | B. | BaCl2、NaCl、H2SO4 | ||
| C. | Ca(OH)2、KNO3、Na2CO3 | D. | Ba(OH)2、NaOH、HNO3 |
14.常温下MFe2Ox(3<x<4)新型纳米材料能使工业废气中的SO2转化为S,反应过程如下:MFe2Ox+SO2═MFe2Oy+S 其中M表示+2价的金属元素.已知MFe2Oy中Fe的化合价为+3价,M在该反应中化合价不变.下列说法错误的是( )
| A. | MFe2Ox可用于环保 | |
| B. | 反应方程式中只有一种物质属于氧化物 | |
| C. | y的数值为4 | |
| D. | 该反应中只有硫元素的化合价发生了变化 |
12.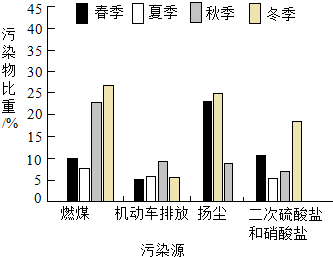 如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )
如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )
 如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )
如图为北京市PM2.5污染物来源的季节变化特征,其中季节变化特征最不明显的污染源来自( )| A. | 燃煤 | B. | 机动车排放 | ||
| C. | 扬尘 | D. | 二次硫酸盐和硝酸盐 |
