题目内容
8.水是生命的源泉,下列“水”中属于纯净物的是( )| A. | 矿泉水 | B. | 冰水混合物 | C. | 雨水 | D. | 自来水 |
分析 本题考查利用纯净物的概念来判断物质是否为纯净物,宏观上看只有一种物质,微观上只有一种分子.
解答 解:A、矿泉水中含有水和多种矿物质,属于混合物,故A错;
B、冰水混合物是由水一种物质组成,属于纯净物,故B正确;
C、雨水中含有水和多种可溶性物质,属于混合物,故C错;
D、自来水中含有水和消毒剂等物质,属于混合物,故D错.
故选B.
点评 在熟悉概念的基础上能从宏观和微观两个方面来判断纯净物和混合物,还要从社会实践中了解生活中常见物质的组成.

练习册系列答案
相关题目
14.在装有一氧化碳气体的钢瓶上,应贴上下列图标( )


| A. | 1和2 | B. | 1和3 | C. | 3和4 | D. | 2和4 |
13.如图1是“XX牌贴身暖宝宝”使用说明书,小王等同学阅读了使用说明后,对它的成分和发热原理产生了兴趣,和同学们一起进行了实验探究.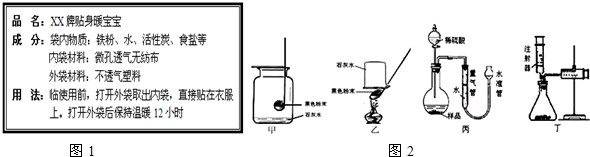
(1)袋内物质中含有的金属元素至少有2种,其外袋材料属于合成(填“无机非金属”、“合成”或“复合”)材料.
(2)初步探究成分及发热原理
【提出问题】:“暖宝宝”为什么能发热?
【做出猜想】:“暖宝宝”发出的热量主要来自铁粉氧化(即生锈)的过程.
【设计实验】:
【继续探究】:小王和同学们想继续探究“暖宝宝”发热后,剩余物质中是否还含有活性炭,他们取适量A袋内物质于烧杯内,加入过量稀盐酸,充分反应后过滤,洗涤、烘干滤渣.为进一步验证黑色滤渣的成分,小王和小李同学分别设计了甲、乙两个如图2所示的装置,点燃滤渣,用澄清石灰水验证产物,你认为甲图的装置结论更可靠,理由是乙方案酒精燃烧生成的CO2会干扰实验.
同学们分析铁生锈是一个缓慢氧化的过程,“暖宝宝”放热现象之所以很明显是因为:①铁呈粉末状,活性炭有吸附性,使铁能与氧气、水等接触充分;②氯化钠能加快铁生锈;
(3)测定“暖宝宝”中的含铁量
取一片包装完好的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【实验方法】:取样品m g,利用如图丙所示装置与药品,测反应后生成气体的体积.
【实验步骤】:
①连接仪器,检查装置气密性;
②将实验所用药品装入各仪器中,记录量气管(水准管中水不会溢出)初始刻度;
③打开分液漏斗活塞,加入足量稀硫酸至不再有气泡冒出.在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移(填“上提”或“下移”).
④等恢复至室温,并调节量气管与水准管两边液面相平后,再次记录量气管刻度;
【数据处理】:
若实验条件下,氢气的密度为d g/mL,测得氢气体积为v mL.则该“暖宝宝”中铁粉的质量分数的表达式为$\frac{28dv}{m}$×100%.
【交流讨论】:利用丙装置,即使操作无失误,测量结果仍会偏大,原因是滴入烧瓶内的稀硫酸占一定体积,小王重新设计了一个如图丁的实验装置,利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀硫酸体积为V1mL,充分反应后,右侧针筒中气体的读数为V2 mL,则反应生成的氢气的体积为V2-V1 mL.
(4)测定“暖宝宝”中的铁、碳质量比
小李取了一片外袋已有部分破损的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【查阅资料】:
①2Fe(OH)3═Fe2O3+3H2O;②Fe+2FeCl3═3FeCl2;③在HCl和FeCl3的混合溶液中Fe先与FeCl3反应
【实验记录】:
【实验结论】:经该实验测定,新产品的配料中碳粉和铁粉的质量比为1.9:7.28,该片已有破损的“暖宝宝”中的剩余铁单质的质量为6.16 g.

(1)袋内物质中含有的金属元素至少有2种,其外袋材料属于合成(填“无机非金属”、“合成”或“复合”)材料.
(2)初步探究成分及发热原理
【提出问题】:“暖宝宝”为什么能发热?
【做出猜想】:“暖宝宝”发出的热量主要来自铁粉氧化(即生锈)的过程.
【设计实验】:
| 实验操作 | 实验现象 | 解释或结论 | |
| 步骤1 | 取A、B两袋“暖宝宝”,将A袋按使用说明打开外袋取出内袋;而B袋不打开外袋.并将两袋样品放置在同样的环境中. | A袋的“暖宝宝”温度很快上升;B袋温度无明显变化. | “暖宝宝”发热是由于袋内物质与O2接触. |
| 步骤2 | 24小时后,分别剪开A、B两袋,各取少量袋内物质于两支试管中,分别加入适量稀盐酸. | A袋内物质部分溶解,产生黄色溶液;B袋内物质部分溶解,有气泡产生,浅绿色溶液. | 用化学方程式表示产生黄色溶液的反应: Fe2O3+6HCl=2FeCl3+3H2O |
| 得出结论:“暖宝宝”发出的热量主要来自铁粉发生氧化(生锈)的过程. | |||
同学们分析铁生锈是一个缓慢氧化的过程,“暖宝宝”放热现象之所以很明显是因为:①铁呈粉末状,活性炭有吸附性,使铁能与氧气、水等接触充分;②氯化钠能加快铁生锈;
(3)测定“暖宝宝”中的含铁量
取一片包装完好的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【实验方法】:取样品m g,利用如图丙所示装置与药品,测反应后生成气体的体积.
【实验步骤】:
①连接仪器,检查装置气密性;
②将实验所用药品装入各仪器中,记录量气管(水准管中水不会溢出)初始刻度;
③打开分液漏斗活塞,加入足量稀硫酸至不再有气泡冒出.在实验过程中,若烧瓶和量气管内气体压强过大,可将水准管下移(填“上提”或“下移”).
④等恢复至室温,并调节量气管与水准管两边液面相平后,再次记录量气管刻度;
【数据处理】:
若实验条件下,氢气的密度为d g/mL,测得氢气体积为v mL.则该“暖宝宝”中铁粉的质量分数的表达式为$\frac{28dv}{m}$×100%.
【交流讨论】:利用丙装置,即使操作无失误,测量结果仍会偏大,原因是滴入烧瓶内的稀硫酸占一定体积,小王重新设计了一个如图丁的实验装置,利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀硫酸体积为V1mL,充分反应后,右侧针筒中气体的读数为V2 mL,则反应生成的氢气的体积为V2-V1 mL.
(4)测定“暖宝宝”中的铁、碳质量比
小李取了一片外袋已有部分破损的“暖宝宝”,剪开包装,利用袋内物质立即进行实验.
【查阅资料】:
①2Fe(OH)3═Fe2O3+3H2O;②Fe+2FeCl3═3FeCl2;③在HCl和FeCl3的混合溶液中Fe先与FeCl3反应
【实验记录】:
【实验结论】:经该实验测定,新产品的配料中碳粉和铁粉的质量比为1.9:7.28,该片已有破损的“暖宝宝”中的剩余铁单质的质量为6.16 g.
17.1869年,俄国科学家门捷列夫对已发现60多种元素的性质进行了研究.当元素按照相对原子质量递增的顺序排列时,同列或同行元素的密度呈现规律性的变化,元素的相对原子质量与相邻(同列、同行)元素的相对原子质量也存在一定的关系.据此他预测了当时还未被发现元素的某些性质并被后来的实验所证明:
部分元素的相对原子质量和密度表
(1)由表中同列元素数据变化可得出:随着元素相对原子质量增大,元素的密度增大;
(2)现有未知元素X与硅和锡处于同一列且位于两者之间,与镓和砷处于同一行且位于两者之间,则未知元素X的相对原子质量约为73.
部分元素的相对原子质量和密度表
| 元素关系 | 同列元素 | 未知元素X的相邻元素 | |||||
| 元素名称 | 钙 | 锶 | 钡 | 硅 | 镓 | 砷 | 锡 |
| 相对原子质量 | 40 | 88 | 137 | 28 | 70 | 75 | 119 |
| 密度(克/厘米3) | 1.55 | 2.60 | 3.62 | 2.40 | 5.89 | 5.72 | 7.30 |
(2)现有未知元素X与硅和锡处于同一列且位于两者之间,与镓和砷处于同一行且位于两者之间,则未知元素X的相对原子质量约为73.
18.一瓶久置的氢氧化钠固体已经发生了变质.某研究性学习小组为了探究变质程度,作出如下猜想:可能部分变质,固体是NaOH和 Na2CO3的混合物;可能全部变质,固体是Na2CO3.
(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是NaOH和Na2CO3混合物;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
计算该样品中Na2CO3的质量分数(写出计算过程).
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量.测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示. 请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量等于变质后消耗盐酸的量(填“大于”、“小于”或“等于”).

(1)首先对固体的成分进行确定.取少量固体于试管中,加水充分溶解,先加入足量的BaCl2 溶液,产生白色沉淀,静置后取上层清液,再加入CuSO4 溶液,产生蓝色絮状沉淀.根据实验现象,可确定该固体是NaOH和Na2CO3混合物;
(2)称取10.6g 该固体样品于锥形瓶中,加入一定质量分数的稀盐酸,直至过量,得到数据如表:
| 样品质量 | 反应前总质量 | 反应后总质量 |
| 10.6克 | 148.5克 | 146.3克 |
(3)再取固体样品溶于水,加入一定质量分数的稀盐酸,直至过量.测出加入稀盐酸的质量与产生CO2气体的质量关系如图所示. 请你分析,一定质量的NaOH固体,变质前后与相同质量分数的稀盐酸反应,变质前消耗盐酸的量等于变质后消耗盐酸的量(填“大于”、“小于”或“等于”).




 如图是密闭体系中某反应的微观示意图,“
如图是密闭体系中某反应的微观示意图,“ ”和“
”和“ ”分别表示微粒.
”分别表示微粒. B、
B、 C、
C、 D、
D、