题目内容
5.在含有稀硫酸、硫酸亚铁、硫酸铜的混合溶液中加入一定量的锌粉,过滤后向滤渣中加入稀盐酸有气泡产生.有下列几种说法:
①滤渣中一定含有铜、铁、锌
②滤渣中一定含有铜、铁,可能有锌
③滤液中一定含有Zn2+,可能有Fe2+和H+,一定没有Cu2+
④向滤液中插入铁丝,铁丝表面无明显现象
上述说法中正确的个数是( )
| A. | 0 | B. | 1 | C. | 2 | D. | 3 |
分析 根据金属活动性顺序表进行分析:在金属活动性顺序中,排在氢前面的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.
解答 解:根据金属活动顺序表可知,锌比铁活泼,铁比铜活泼.所以,加入一定量的锌粉,首先锌粉和硫酸铜溶液反应,置换出单质铜,如果锌粉足量可以继续与硫酸亚铁反应置换出铁.由题意可知,向滤出的固体中滴加稀盐酸,没有气泡产生,说明固体中不含有和稀盐酸反应的金属,由题可知,说明没有锌剩余,且没有生成铁单质,说明溶液中的硫酸亚铁未参加反应,锌粉不足.
①滤出固体不可能有铁和锌,因为二者和盐酸反应有气体生成,所以不正确;
②向反应后的滤渣加入盐酸有气体产生,说明一定有氢前面的金属,铁铜一定存在,锌可能存在:滤液中加入铁所以正确;
③因为锌粉参与反应,所以滤液一定有硫酸锌.由于生成的固体不能与盐酸反应生成氢气,即不存在铁单质,所以铁元素就一定在溶液中,即硫酸亚铁不可能参与反应,所以也一定有,当锌粉少量时,硫酸铜可能剩余,所以不正确;
④硫酸铜一定有镁,向滤液中插入铁丝,铁丝表面无明显现象,所以正确;
故选项为:C.
点评 本题主要考查了学生对金属活动顺序表的运用,在解题时要注意对半定量(如一定量、过量、少量等)概念的理解和掌握并要充分利用验证性的现象来分析反应的程度.

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
16.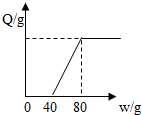 向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
 向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )
向100g含有氯化氢和氯化镁的混合溶液中加入20%的氢氧化钠溶液,产生沉淀的质量Q与加入氢氧化钠溶液的质量W的关系如图所示,则原混合溶液中氯元素的质量分数为( )| A. | 14.2% | B. | 7.1% | C. | 3.55% | D. | 10% |
20.下列图象与对应选项关系合理的是( )
| A. | 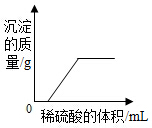 向氯化钡和氢氧化钠的混合溶液中滴加稀硫酸 | |
| B. |  用相同质量的氯酸钾固体加热分解来制取氧气 | |
| C. | 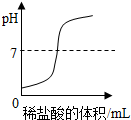 向一定体积的氢氧化钠溶液中逐滴加入稀盐酸 | |
| D. |  向一定质量一定质量分数的稀盐酸中加入铁粉 |
17.下列关于氧气的说法中正确的是( )
| A. | 氧气质量约占空气总质量的$\frac{1}{5}$ | |
| B. | 氧气可以支持燃烧,说明氧气具有可燃性 | |
| C. | 工业上用分离液态空气法制取氧气是分解反应 | |
| D. | 氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动 |
14.下列实验现象的描述错误的是( )
| A. | 将一根光亮的铜丝放在酒精灯火焰上灼烧,铜丝表面变黑 | |
| B. | 小木条蘸一些硫粉燃烧,生成能使稀高锰酸钾溶液由浅绿色褪为无色的气体 | |
| C. | 将连有电流表的铜片和锌片一起插入盛有硫酸铜溶液的烧杯中,电流表指针偏转 | |
| D. | 向鸡蛋清溶液中加几滴稀硝酸,微热,产生黄色沉淀 |
15.小明和小亮同学在实验室帮老师配制石灰水时,将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是小明认为熟石灰样品已经变质.小亮同学不同意他的判断,你认为小亮同学的理由Ca(OH)2微溶于水.同学们针对该熟石灰样品的成分展开了讨论,请你参与讨论并完成实验报告.
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是Ca(OH)2和CaCO3.
【实验与结论】请你通过实验验证你的猜想:
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应密封保存熟石灰.
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是Ca(OH)2和CaCO3.
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤. 向滤液中加入适量的酚酞溶液; | 溶液变为红色; | 乙的猜想不正确 |
| 向滤出固体中加入适量稀盐酸溶液. | 固体溶解,有气泡产生. | 你的猜想正确 |

