题目内容
10.我国劳动人民在公元前7世纪就开始使用石灰、像城墙、庙宇、房屋、古长城的修筑等,都使用了石灰,若得到28t氧化钙,至少需要含碳酸钙80%的石灰石多少吨?(写出计算过程,结果精确到0.1t)分析 将生石灰的质量代入碳酸钙分解的反应方程式来计算碳酸钙的质量,然后利用碳酸钙的质量分数来计算石灰石的质量.
解答 解:设用去的碳酸钙的质量为x,
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
100 56
x 28t
$\frac{100}{x}$=$\frac{56}{28t}$,
解得x=50t
则需要80%的石灰石的质量为$\frac{50t}{80%}$=62.5t,
答:需要含碳酸钙80%的石灰石质量为62.5t.
点评 本题考查学生利用化学反应方程式的计算,学生应明确纯物质的纯质量才能代入化学反应方程式来计算,并注意计算格式的规范和清晰的解答思路.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.下列图象与对应选项关系合理的是( )
| A. | 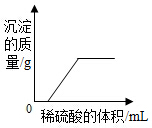 向氯化钡和氢氧化钠的混合溶液中滴加稀硫酸 | |
| B. |  用相同质量的氯酸钾固体加热分解来制取氧气 | |
| C. | 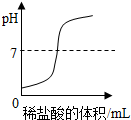 向一定体积的氢氧化钠溶液中逐滴加入稀盐酸 | |
| D. |  向一定质量一定质量分数的稀盐酸中加入铁粉 |
1.下列除去杂质(括号内)的方法正确的是( )
| A. | N2中的(O2):红热的木炭 | B. | CaO (CaCO3):加适量稀盐酸 | ||
| C. | NaCl溶液(盐酸):加热蒸发 | D. | 铁粉(铜粉):加入足量稀硫酸 |
5.洗发水中一般含有少许二恶烷(化学式是C4H8O2),二恶烷主要用作溶剂、乳化剂、去垢剂等.下列有关二恶烷的说法正确的是( )
| A. | 二恶烷属于有机高分子化合物 | |
| B. | 二恶烷中含有4个碳原子、8个氢原子和2个氧原子 | |
| C. | 二恶烷中碳元素的质量分数约是54.5% | |
| D. | 二恶烷中碳、氢、氧三种元素的质量比是2:4:1 |
15.小明和小亮同学在实验室帮老师配制石灰水时,将两药匙熟石灰样品放入小烧杯中,向其中加入一定量的蒸馏水,充分搅拌后发现烧杯底部仍有不溶性的固体,于是小明认为熟石灰样品已经变质.小亮同学不同意他的判断,你认为小亮同学的理由Ca(OH)2微溶于水.同学们针对该熟石灰样品的成分展开了讨论,请你参与讨论并完成实验报告.
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是Ca(OH)2和CaCO3.
【实验与结论】请你通过实验验证你的猜想:
【拓展与应用】小组同学反思了熟石灰变质的原因,认识到实验室应密封保存熟石灰.
【提出问题】熟石灰样品的主要成分是什么?
【作出猜想】甲同学猜想是Ca(OH)2;
乙同学猜想是CaCO3
你认为是Ca(OH)2和CaCO3.
【实验与结论】请你通过实验验证你的猜想:
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量的熟石灰样品于烧杯中,加适量的水充分溶解后过滤. 向滤液中加入适量的酚酞溶液; | 溶液变为红色; | 乙的猜想不正确 |
| 向滤出固体中加入适量稀盐酸溶液. | 固体溶解,有气泡产生. | 你的猜想正确 |
2.酸与碱作用生成盐和水的反应,叫做中和反应.下列应用与中和反应原理无关的是( )
| A. | 施用熟石灰改良酸性土壤 | |
| B. | 服用含Mg(OH)2的药物治疗胃酸过多 | |
| C. | 用熟石灰和硫酸铜配制波尔多液 | |
| D. | 用NaOH溶液洗涤石油产品中的残余硫酸 |

 A,B,C,D,E是初中化学中常见的五种物质,它们都含有一种相同的元素,如图表示各物质的转化关系.其中,A为食盐的主要成分,B中含钡元素,D为有颜色溶液,E为蓝色溶液,其它物质的溶液都为无色;反应⑤和⑥为置换反应,其它均为分解反应.(1)写出物质C的化学式HCl.
A,B,C,D,E是初中化学中常见的五种物质,它们都含有一种相同的元素,如图表示各物质的转化关系.其中,A为食盐的主要成分,B中含钡元素,D为有颜色溶液,E为蓝色溶液,其它物质的溶液都为无色;反应⑤和⑥为置换反应,其它均为分解反应.(1)写出物质C的化学式HCl.