题目内容
14.类比归纳是学习化学的一种方法,下面是某同学对一氧化碳和二氧化碳的相关知识归纳,请回答.| 一 | 一氧化碳 | 二氧化碳 |
| 相同点 | 无色无味的气体 | |
| 不同点 | 密度比空气小 | 密度比空气大 |
| 难溶于水 | 能溶于水 | |
| 有毒 | 无毒 | |
| 有可燃性 | 不能燃烧,不能支持燃烧 | |
| 有还原性 | 有氧化性 | |
| 不能与碱溶液反应 | 能与碱溶液反应 | |
(2)若在实验室收集一氧化碳气体,可采用的方法是排水法.
(3)用一个化学方程式表示一氧化碳的可燃性2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.
(4)除去二氧化碳中混有的少量一氧化碳,可采取的方法是把混合气体通过灼热的氧化铜.
(5)鉴别一氧化碳、二氧化碳两种气体的方法通入澄清的石灰水,观察是否能使澄清的石灰水变浑浊.(写出一种即可).
分析 (1)根据结构决定性质来分析;
(2)根据一氧化碳的性质来分析;
(3)一氧化碳燃烧生成二氧化碳;
(4)根据二者性质上的区别来分析;
(5)区别一氧化碳和二氧化碳两种无色气体,要求根据两种气体性质的不同,设计的方案能出现两种明显不同的实验现象,才能达到达到一次鉴别出两瓶气体的目的.
解答 解:(1)每个一氧化碳分子中含有1个碳原子和1个氧原子,每个二氧化碳分子中含有1个碳原子和2个氧原子,因为一氧化碳分子和二氧化碳分子的结构不同,所以一氧化碳和二氧化碳的化学性质不同.故填:分子结构不同;
(2)因为一氧化碳有毒,难溶于水,故可采用排水法来收集;故填:排水法;
(3)CO与氧气在点燃的条件下反应生成二氧化碳,故填:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2;
(4)CO在高温下与氧化铜反应生成铜和气体二氧化碳,因此把混合气体通过灼热的氧化铜可以较彻底地除去混在二氧化碳中的少量的一氧化碳气体;故填:把混合气体通过灼热的氧化铜;
(5)二氧化碳能使澄清的石灰水变浑浊,一氧化碳不能,可以鉴别;一氧化碳能点燃后燃烧,并发出蓝色火焰,而二氧化碳不燃烧.故填:通入澄清的石灰水,观察是否能使澄清的石灰水变浑浊.
点评 物质的结构组成不同物质的性质也就有很大差异,对比相似的物质可以更好地认识和掌握物质.

练习册系列答案
相关题目
4. 实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
【提出问题1】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:全部是NaOH 猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有NaOH和Na2CO3.
【查阅资料】CO2在饱和碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如表实验方案,请你一起完成下列实验报告.
回答下列问题(1)实验室中,氢氧化钠固体应怎样保存?密封保存
(2)用酚酞试液不能(填“能”或“不能”)检验氢氧化钠变质.
(3)若取少量的固体溶于水,滴加几滴稀盐酸,没有气泡产生.不能(填“能”或“不能”)证明氢氧化钠固体没有变质.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图所示装置(铁架台略去),实验在20℃,101kPa下进行,步骤如下:
①按图连接好装置;
②检查装置气密性
③用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢钠溶液224mL.
请回答下列问题:
(1)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由避免CO2溶解在水中有损耗,导致测定结果偏低.
(2)试管中原有的空气对实验结果没有明显影响理由是因为试管中原有空气的体积与反应后试管中没有排尽的二氧化碳的体积几乎等同.
(3)变质氢氧化钠样品中碳酸钠的质量分数为53%(20℃,101kPa下,22.4L二氧化碳的质量为44g)
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成Na2SO4和NaHCO3、Na2SO4、Na2SO4H2SO4.
 实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.
实验室有一瓶长期暴露在空气中的氢氧化钠固体样品,观察发现,样品表面有白色粉末.某兴趣小组的同学对该样品的成分及含量进行了探究.【提出问题1】该样品中含有那些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:全部是NaOH 猜想Ⅱ:已完全变质,该样品中只含Na2CO3;
猜想Ⅲ:部分变质,该样品中含有NaOH和Na2CO3.
【查阅资料】CO2在饱和碳酸氢钠溶液中几乎不溶解.
【实验探究1】为确定该样品的成分,小明设计了如表实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| 1)取少量样品溶于水,加入过量的CaCl2溶液 | 白色沉淀产生 | 该反应的化学方程式:CaCl2+Na2CO3=2NaCl+CaCO3 氢氧化钠已经变质 |
| 2)将上述反应后的混合物过滤,取滤液加入酚酞溶液 | 变红 | 证明猜想Ⅲ正确 |
(2)用酚酞试液不能(填“能”或“不能”)检验氢氧化钠变质.
(3)若取少量的固体溶于水,滴加几滴稀盐酸,没有气泡产生.不能(填“能”或“不能”)证明氢氧化钠固体没有变质.
【提出问题2】如何测量该部分变质样品中碳酸钠的质量分数?
【实验探究2】小红同学设计如图所示装置(铁架台略去),实验在20℃,101kPa下进行,步骤如下:
①按图连接好装置;
②检查装置气密性
③用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入饱和碳酸氢钠溶液至瓶颈处;
④向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到饱和碳酸氢钠溶液224mL.
请回答下列问题:
(1)B中集气瓶盛放的饱和碳酸氢钠溶液不能用水代替,其理由避免CO2溶解在水中有损耗,导致测定结果偏低.
(2)试管中原有的空气对实验结果没有明显影响理由是因为试管中原有空气的体积与反应后试管中没有排尽的二氧化碳的体积几乎等同.
(3)变质氢氧化钠样品中碳酸钠的质量分数为53%(20℃,101kPa下,22.4L二氧化碳的质量为44g)
【拓展提高】已知Na2CO3溶液与稀硫酸反应先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成Na2SO4和NaHCO3、Na2SO4、Na2SO4H2SO4.
2.某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多 气泡产生(如图2).该小组同学进行如下探究.
气泡产生(如图2).该小组同学进行如下探究.
探究一:该气体的成分.
【猜想与假设】小华说:该气体可能是CO2、O2、CO、H2、
N2.
小明说:不可能含有N2,因为维C泡腾片和水中无氮元素.
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,
H2易燃易爆,CO 有毒;
该小组同学认为:该气体可能含有CO2、O2中的一种或两种.
【进行实验】
【得出结论】
(1)由实验①可知,该气体中肯定含有CO2.写出该反应的化学方程式CO2+Ca(OH)2=CaCO3↓+H2O.
(2)由实验②不能(填“能”或“不能”)确定该气体中不含氧气.
探究二:维C泡腾片溶液的酸碱性.向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显酸性.
 气泡产生(如图2).该小组同学进行如下探究.
气泡产生(如图2).该小组同学进行如下探究.探究一:该气体的成分.
【猜想与假设】小华说:该气体可能是CO2、O2、CO、H2、
N2.
小明说:不可能含有N2,因为维C泡腾片和水中无氮元素.
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,
H2易燃易爆,CO 有毒;
该小组同学认为:该气体可能含有CO2、O2中的一种或两种.
【进行实验】
| 实验编号 | 实验操作 | 实验现象 |
| ① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
| ② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
(1)由实验①可知,该气体中肯定含有CO2.写出该反应的化学方程式CO2+Ca(OH)2=CaCO3↓+H2O.
(2)由实验②不能(填“能”或“不能”)确定该气体中不含氧气.
探究二:维C泡腾片溶液的酸碱性.向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显酸性.
9.下列有关金属的说法正确的是( )
| A. | 金属在常温下都呈固体 | B. | 金属是由原子构成的单质 | ||
| C. | 铝比铁在空气中容易腐蚀 | D. | 金属都能与酸反应生成氢气 |
19.下列属于化学变化的是( )
| A. | 风力发电 | B. | 酒精挥发 | C. | 液氮汽化 | D. | 秸秆焚烧 |
6.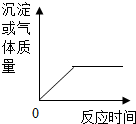 下列实验过程与如图相符的是( )
下列实验过程与如图相符的是( )
 下列实验过程与如图相符的是( )
下列实验过程与如图相符的是( )| A. | 加热氯酸钾 | |
| B. | 向稀硫酸中滴入氯化钡溶液 | |
| C. | 向氯化钠溶液中滴加硝酸钾溶液 | |
| D. | 向装有生锈铁钉的试管中倒入少量稀硫酸 |
4.下列物质的用途中,利用其物理性质的是( )
| A. | 氧气用于气焊 | B. | 硫酸用于处理碱性废液 | ||
| C. | 干冰用作冷冻剂 | D. | 氢气常用作保护气 |