题目内容
3.(1)食用海鱼摄取的主要营养素是蛋白质.(2)如图1是应急净水器.利用该净水器将2000g含氯化钠3%的海水暴晒4小时,收集到500g可饮用水,此时剩余海水中氯化钠的质量分数为4%.
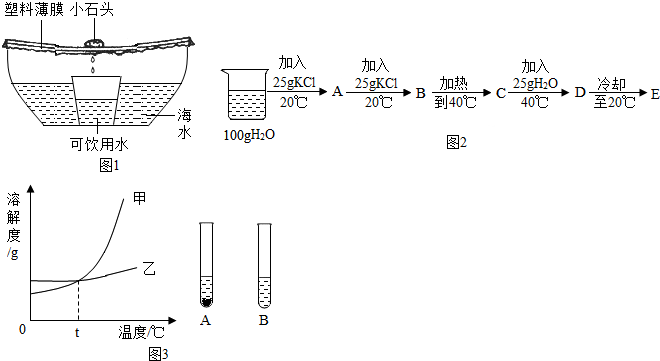
(3)已知KCl的溶解度20°C时为34g,40°C时为40g.某实验小组做了如图2实验.
①B所得溶液中溶质与溶剂的质量比为17:50;
②A~E所得溶液中,没有固体剩余的饱和溶液是D(填序号,下同),溶质的质量分数相等的是B与E和C与D.
(4)甲、乙两物质的溶解度曲线如图3.20℃将等质量的甲、乙两种固体分别加入盛有10g水的A、B试管中充分溶解,可观察到如图现象.20℃时对A试管进行如下操作,最终A试管中溶液溶质的质量分数一定发生变化的是af.
a.加足量水 b.加入足量甲物质 c.升温到40℃d.蒸发部分溶剂,恢复到20℃
e.加入少量40℃甲的饱和溶液,恢复到20℃f.加入足量的不饱和A溶液.
分析 (1)鱼类中含有较多的蛋白质,可以据此解答;
(2)根据溶质质量不变计算;
(3)从饱和溶液和不饱和溶液中溶质与溶剂的关系去分析解答;
(4)据溶质的质量分数的计算方法结合选项分析解答.
解答 解:(1)鱼类中含有较多的蛋白质,所以食用海鱼摄取的主要营养素是蛋白质;故填:蛋白质;
(2)剩余海水中氯化钠的质量分数为:$\frac{2000g×3%}{2000g-500g}×100%$=4%;故填4%;
(3)①已知KCl的溶解度20℃时为34g.其含义为:在20℃时在100g水里,最多能溶解34g氯化钾;溶质与溶剂的质量比为34:100=17:50;
在A中,由于氯化钾的质量25g<34g,此时所得溶液为不饱和溶液,溶质的质量为:$\frac{25g}{25g+100g}$×100%=20%;
在B中,溶质质量为25g+25g=50g,但在20℃在100g水里,最多能溶解34g氯化钾,此时溶质有剩余:50g-34g=16g,因此溶液中的溶质与溶剂的质量比为:34g:100g=17:50;溶质的质量分数为:$\frac{34g}{34g+100g}$×100%=25.4%;
在C中在40℃时,此时由于氯化钾的溶解度为40g,C中的溶质仍有剩余(50g-40g=10g);溶质的质量分数为:$\frac{40g}{100g+40g}$×100%=28.6%;
在D中设125g水中最多溶解氯化钾的质量为X,
40g/100g=X/125g;解之得:X=50g;故此时溶液恰好饱和;
溶质的质量分数为:$\frac{50g}{50g+125g}$×100%=28.6%
在E中当冷却到20℃时,100g水中最多可溶解34氯化钾,由于溶液具有均一性,所以125g水中最多可溶解42.5g,此时为饱和溶液,故溶质的质量分数为:$\frac{42.5g}{125g+42.5g}$×100%=25.4%;
②由上面①的分析可知答案为:17:50;D B与E和C与D
(4)20℃时试管中的甲溶液是饱和溶液,若升温到40℃,其溶解度增大,溶质、溶剂的质量不变,所以溶质的质量分数不变;加少量甲物质,溶液已经是该温度下的饱和溶液,不会再溶解甲,溶质、溶剂的质量不变,所以溶质的质量分数不变;加较多的水,试管中剩余的甲会继续溶解变为不饱和溶液,溶质的质量分数减小;温度不变,蒸发溶剂,恢复到20℃,溶质的质量分数不变;
故答案为:af.
点评 要想解答好这类题目,首先,要理解和熟记对海洋资源的合理开发与利用,以及与之相关的知识.然后,根据所给的问题情景或图表信息等,结合所学的相关知识和技能,并细心地探究、推理后,按照题目要求进行认真地选择或解答即可.

| 一 | 一氧化碳 | 二氧化碳 |
| 相同点 | 无色无味的气体 | |
| 不同点 | 密度比空气小 | 密度比空气大 |
| 难溶于水 | 能溶于水 | |
| 有毒 | 无毒 | |
| 有可燃性 | 不能燃烧,不能支持燃烧 | |
| 有还原性 | 有氧化性 | |
| 不能与碱溶液反应 | 能与碱溶液反应 | |
(2)若在实验室收集一氧化碳气体,可采用的方法是排水法.
(3)用一个化学方程式表示一氧化碳的可燃性2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.
(4)除去二氧化碳中混有的少量一氧化碳,可采取的方法是把混合气体通过灼热的氧化铜.
(5)鉴别一氧化碳、二氧化碳两种气体的方法通入澄清的石灰水,观察是否能使澄清的石灰水变浑浊.(写出一种即可).
| A. | Mg | B. | Cu | C. | Fe | D. | Na |
| A. | H2SO4 $\stackrel{+BaCl_{2}}{→}$HCl | B. | CO $\stackrel{+NaOH}{→}$ Na2CO3 | ||
| C. | Cu(OH)2 $\stackrel{+NaCl}{→}$ NaOH | D. | NaNO3 $\stackrel{BaCl_{2}}{→}$ Ba(NO3)2 |
| 花的种类 | 花汁在酒精中的颜色 | 花汁在酸溶液中的颜色 | 花汁在碱溶液中的颜色 |
| 大红花 | 粉红色 | 橙色 | 绿色 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 雏菊 | 无色 | 无色 | 黄色 |
| A. | 研磨花瓣时加入酒精是为了溶解其中的色素 | |
| B. | 在pH=10的溶液中大红花汁会变成橙色 | |
| C. | 万寿菊花汁不能用作酸碱指示剂 | |
| D. | 可用雏菊花汁来区别稀盐酸和氢氧化钠溶液 |
| A. | 酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| B. | 酸溶液中都含有氢离子,所以含有氢元素的物质一定是酸 | |
| C. | 有机物都含有碳元素,所以含有碳元素的化合物一定是有机物 | |
| D. | 化合物是由不同元素组成的纯净物,所以只含一种元素的物质一定不是化合物 |