题目内容
13.有一在空气中暴露过的氢氧化钠固体,经分析知其中含水7%,含碳酸钠53%,其余为氢氧化钠.取一定量的该固体,加入100克浓度为14.6%的稀盐酸,恰好完全反应,将所得溶液蒸干,得到固体的质量为多少克.分析 氢氧化钠和稀盐酸反应生成氯化钠和水,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳;
该固体中的钠元素完全转化到最后得到的固体氯化钠中,根据稀盐酸的质量、溶质质量分数可以计算得到的氯化钠的质量.
解答 解:设最后得到固体氯化钠的质量为x,
由NaOH+HCl═NaCl+H2O,Na2CO3+2HCl═2NaCl+H2O+CO2↑,可知,HCl~NaCl,
HCl~NaCl,
36.5 58.5
100g×14.6% x
$\frac{36.5}{100g×14.6%}$=$\frac{58.5}{x}$,
x=23.4g,
答:将所得溶液蒸干,得到固体的质量为23.4g.
点评 解答的关键在于通过两个反应的化学方程式找出稀盐酸和生成氯化钠之间的质量关系,再进行计算就比较简单了.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.化学兴趣小组的同学学习了对蜡烛及其燃烧的探究实验后受到启发,欲证明纸张燃烧的产物有水和二氧化碳,设计了实验,请帮助完成表格.
| 实验操作 | 实验现象 | 结论 |
| 点燃纸张,在火焰上方罩上光洁干燥的冷玻璃杯 | 玻璃杯内壁有水雾 | 纸张燃烧的产物有水. |
| 把玻璃杯迅速倒转过来倒入澄清石灰水 | 石灰水变浑浊 | 纸张燃烧的产物有二氧化碳. |
18.某溶液中含有阳离子Ag+、Ba2+、Cu2+.现要依次分别除去此溶液中这三种阳离子,可使用的试剂为Na2SO4、NaCl、NaOH,加入的顺序为( )
| A. | NaOH、Na2SO4、NaCl | B. | NaCl、NaOH、Na2SO4 | ||
| C. | NaCl、Na2SO4、NaOH | D. | Na2SO4、NaCl、NaOH |
3.有一瓶暴露在空气中的氢氧化钠样品,发现已经部分变质,向此样品中加入100g 14.6%的稀盐酸,再加入10.2%的氢氧化钠溶液至溶液呈中性,然后将溶液蒸干,则可得固体的质量为( )
| A. | 14.5g | B. | 23.4g | C. | 11.7g | D. | 无法计算 |
 某研究性学习小组在协助老师清理实验室时,发现一批存放多年的氢氧化钙.为检验其变质情况,进行了如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,振荡形成悬浊液,放在电子天平上,向锥形瓶中逐滴滴加14.6%的稀盐酸,如图甲所示,振荡后读取质量.得到锥形瓶中物质的质量与稀盐酸质量关系,如图乙所示,试求:
某研究性学习小组在协助老师清理实验室时,发现一批存放多年的氢氧化钙.为检验其变质情况,进行了如下探究:取氢氧化钙样品11.4g于锥形瓶中,加入38.6g水,振荡形成悬浊液,放在电子天平上,向锥形瓶中逐滴滴加14.6%的稀盐酸,如图甲所示,振荡后读取质量.得到锥形瓶中物质的质量与稀盐酸质量关系,如图乙所示,试求:
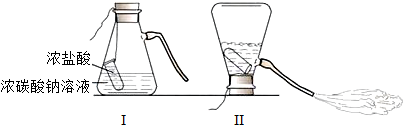 某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究.
某化学兴趣小组的同学学习“灭火器原理”后,设计了如图所示实验,并对反应后瓶中残留废液进行探究.