题目内容
18.某溶液中含有阳离子Ag+、Ba2+、Cu2+.现要依次分别除去此溶液中这三种阳离子,可使用的试剂为Na2SO4、NaCl、NaOH,加入的顺序为( )| A. | NaOH、Na2SO4、NaCl | B. | NaCl、NaOH、Na2SO4 | ||
| C. | NaCl、Na2SO4、NaOH | D. | Na2SO4、NaCl、NaOH |
分析 将三种离子逐一沉淀并分离,即加入一种试剂只能生成一种沉淀,需要考虑每次所加入的试剂只能与溶液中的一种离子反应形成沉淀.
解答 解:氯化钠只能与溶液中Ag+形成氯化银沉淀,然后加入的氢氧化钠只与溶液中Cu2+形成氢氧化铜沉淀,最后加入的硫酸钠沉淀溶液中的Ba2+形成硫酸钡沉淀.
故选:B
点评 本题考查物质的分离提纯实验方案的设计,题目难度不大,解题时要注意题目逐一沉淀的要求,熟练掌握复分解反应的实质是正确解答本题的前提.

练习册系列答案
相关题目
6.如图实验操作正确的是( )
| A. |  振荡试管 | B. |  稀释浓硫酸 | C. |  加热液体 | D. |  量取液体 |
7.能说明镁条燃烧是化学变化的实验现象是( )
| A. | 发出耀眼的白光 | B. | 放出大量的热量 | ||
| C. | 打磨后镁条变亮 | D. | 生成不同于镁条的白色粉末 |
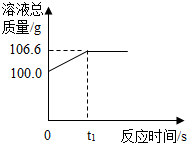 为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.
为测定某赤铁矿石中氧化铁的质量分数,小龙和他的同学用足量的一氧化碳与10g赤铁矿石样品充分反应(杂质不参与反应),并将生成的气体用一定量的氢氧化钠溶液完全吸收,该溶液总质量与反应时间的变化关系如图.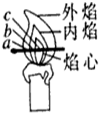 小李对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究.请填写下列空格:
小李对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究.请填写下列空格: