题目内容
11. 向微型实验仪器井穴板的4个井穴(已编号)中分别滴加盐酸、醋酸、硫酸铝和氯化铵四种溶液各3滴,再各加1滴紫色石蕊试液(所有试剂用量共约0.8m),观察到四种溶液均变红.由本实验得出的以下结论中正确的是
向微型实验仪器井穴板的4个井穴(已编号)中分别滴加盐酸、醋酸、硫酸铝和氯化铵四种溶液各3滴,再各加1滴紫色石蕊试液(所有试剂用量共约0.8m),观察到四种溶液均变红.由本实验得出的以下结论中正确的是( )
①pH<7的溶液不一定是酸溶液
②盐溶液不一定呈中性
③用微型实验仪器做实验可节省药品
④微型实验可减少污染.
| A. | ①②③④ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
分析 紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝,据此结合溶液的酸碱性与pH的关系、酸碱盐的特征等进行分析判断即可.
解答 解:紫色石蕊溶液遇酸性溶液变红,遇碱性溶液变蓝;由题意,盐酸、醋酸、硫酸铝和氯化铵四种溶液各3滴,再各加1滴紫色石蕊试液,四种溶液均变红,说明四种溶液均显酸性,pH均小于7.
①硫酸铝和氯化铵均是由金属(铵根离子)阳离子和酸根离子构成的,均属于盐,说明pH<7的溶液不一是酸溶液,故选项说法正确.
②由硫酸铝和氯化铵的水溶液显酸性,说明盐溶液不一定呈中性,故选项说法正确.
③本实验所有试剂用量共约0.8mL,由此可见用微型实验仪器做实验,可节省药品,故选项说法正确.
④微型实验备受青睐,可以减少污染,使实验的绿色化,故选项说法正确.
故①②③④说法均正确.
故选A.
点评 本题难度不大,掌握紫色石蕊溶液与酸碱溶液的变色情况、溶液的酸碱性和溶液pH大小之间的关系、酸碱盐的特征是正确解答本题的关键.

练习册系列答案
相关题目
1.张亭栋教授因发现砒霜(主要成分为三氧化二砷,分子式为As2O3)在治疗白血病方面的重要作用而荣获2015年度“求是杰出科学家奖”.下列有关As2O3的说法正确的是( )
| A. | As203中砷元素的化合价为+3 | |
| B. | As203为金属氧化物 | |
| C. | 一个As203分子中含有一个臭氧分子 | |
| D. | As203分子中砷与氧元素的质量比为2:3 |
2.下列各组物质,其化学性质不相似的是( )
| A. | 冰、干冰 | B. | 锌、铁 | ||
| C. | 氢氧化钙、氢氧化钠 | D. | 稀盐酸、稀硫酸 |
6. 小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.
小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.
【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】
A.可能与酸的浓度有关;
B.可能与金属的种类有关;
C.可能与金属的形状有关.
【设计并实验】小明和小芳进行如下实验.
(1)实验时需将镁片和铁片进行打磨,其目的是除去金属表面的氧化物.
(2)写出铁与稀盐酸反应的化学方程式:Fe+2HCl=FeCl2+H2↑.
【收集证据】
(3)要比较不同金属的种类对反应快慢的影响,应选择的实验编号是②③.
【得出结论】
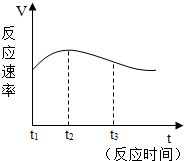
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应.实验测得该反应中产生气体的速率(V)与时间(t)的关系如图所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因由于镁与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢.
【实验反思】本实验采用的定量比较气体产生速率的方法是收集相同体积的气体需要的时间.
 小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.
小民同学在练习“金属的化学性质”实验操作时,发现几支试管中气泡有快有慢,于是他与小芳同学一起合作进行如下探究.【提出问题】金属与酸反应的快慢受哪些因素影响呢?
【猜想与假设】
A.可能与酸的浓度有关;
B.可能与金属的种类有关;
C.可能与金属的形状有关.
【设计并实验】小明和小芳进行如下实验.
| 实验编号 | 盐酸的浓度 (均取20mL) | 金属 (均取2g) | 金属的形状 | 收集50mL氢气所需要时间/s |
| ① | 10% | 镁 | 粉状 | 60 |
| ② | 10% | 铁 | 片状 | 120 |
| ③ | 10% | 镁 | 片状 | 102 |
| ④ | 20% | 铁 | 片状 | 110 |
(2)写出铁与稀盐酸反应的化学方程式:Fe+2HCl=FeCl2+H2↑.
【收集证据】
(3)要比较不同金属的种类对反应快慢的影响,应选择的实验编号是②③.
【得出结论】
(4)实验①中试管外壁发烫,说明镁与稀盐酸反应是放热反应.实验测得该反应中产生气体的速率(V)与时间(t)的关系如图所示,你认为在t2~t3时间段内反应速率逐渐减慢的主要原因由于镁与盐酸反应消耗了盐酸,盐酸的浓度变小,因此反应速率逐渐减慢.
【实验反思】本实验采用的定量比较气体产生速率的方法是收集相同体积的气体需要的时间.
3.央视2016年3.15主题是“新消费•我做主”,曝光了很多与食品相关的问题,下列做法正确的是( )
| A. | 在排骨汤中放入食用碘盐调味 | B. | 白酒中加入超量塑化剂使口感更好 | ||
| C. | 用鱼粉、工业明胶合成鱼翅 | D. | 鸡饲料中添加各种抗生素使鸡速成 |

