题目内容
18.实验室有一包铜粉和铁粉的混合粉末,为研究样品的组成.某同学取样品8.8g放入烧杯中,向烧杯中加入足量的硝酸银溶液,充分反应后过滤,洗涤干燥,称量固体质量为32.4g,问混合粉末中铜粉和铁粉的质量比为( )| A. | 8:7 | B. | 7:8 | C. | 4:7 | D. | 1:2 |
分析 根据铜和硝酸银反应生成硝酸铜和银,铁和硝酸银反应生成硝酸亚铁和银,依据固体质量的改变进行分析.
解答 解:设混合物中铜的质量为x,则铁的质量为(8.8-x)
Cu+2AgNO3=Cu(NO3)2+2Ag
64 216
x $\frac{216x}{64}$
Fe+2Ag(NO3)2=Fe(NO3)2+2Ag
56 216
8.8-x $\frac{216(8.8-x)}{56}$
所以$\frac{216x}{64}$+$\frac{216(8.8-x)}{56}$=32.4g
x=3.2g
所以混合粉末中铜粉和铁粉的质量比为3.2g:(8.8g-3.2g)=4:7
故选:C.
点评 不同主要考查了化学方程式的计算,难度不大,注意解题的规范性和准确性.

练习册系列答案
相关题目
5.下列四个图象中不正确的是( )
| A. |  电解水 | B. |  木炭在密闭容器内燃烧 | ||
| C. |  加热一定量的高锰酸钾固体 | D. |  木炭还原氧化铜 |
12.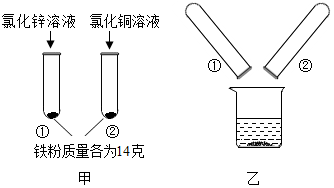 为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )
为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )
 为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )
为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )| A. | 甲图试管①中溶液颜色发生改变 | |
| B. | 甲图试管②中的溶液中含有FeCl3 | |
| C. | 乙图烧杯中的溶液一定只含有两种溶质 | |
| D. | 乙图烧杯中最后所得固体的质量可能等于3.2g |
10.连续多日的雾霾给我们的健康带来危害,下列措施不利于防治雾霾的是( )
| A. | 大力植树造林 | B. | 使用清洁能源 | C. | 乘坐公交出行 | D. | 露天焚烧垃圾 |

 请根据如图标签的信息回答:
请根据如图标签的信息回答: