题目内容
12.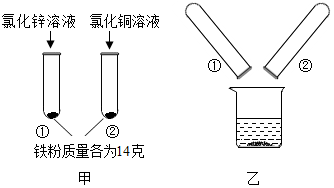 为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )
为探究锌、铜、铁三种金属的活动性顺序,某小组做了如甲图所示实验.实验结束后,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多(如乙图所示).下列说法正确的是( )| A. | 甲图试管①中溶液颜色发生改变 | |
| B. | 甲图试管②中的溶液中含有FeCl3 | |
| C. | 乙图烧杯中的溶液一定只含有两种溶质 | |
| D. | 乙图烧杯中最后所得固体的质量可能等于3.2g |
分析 根据三种的金属的活动性顺序是锌、铁、铜,所以铁不会与氯化锌反应,铁会置换出氯化铜中的铜,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,说明铁又会置换出氯化铜中的铜,然后依据题中的选项进行分析.
解答 解:三种的金属的活动性顺序是锌、铁、铜,所以铁不会与氯化锌反应,铁会置换出氯化铜中的铜,将试管①、试管②内的物质全部倒入同一烧杯中,充分反应后发现烧杯中的红色固体物质明显增多,说明铁又会置换出氯化铜中的铜,所以
A、通过上面的分析可知,铁不会与氯化锌反应,甲图试管①中溶液颜色不发生改变,故错误;
B、铁会置换出氯化铜中的铜,生成氯化亚铁和铜,不是氯化铁,故错误;
C、将甲实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,说明实验①没有反应的铁粉又和实验②中剩余的硫酸铜溶液生成铜和硫酸亚铁,一定含有氯化亚铁,但是氯化铜的量不能确定,题中的现象不能确定反应后烧杯中的溶液是否含有氯化铜,故错误;
D、假设铁完全反应,乙图烧杯中最后所得固体的质量为x
Fe+CuSO4═Cu+FeSO4;
56 64
2.8g x
$\frac{56}{2.8g}=\frac{64}{x}$
x=3.2g
则乙图烧杯中最后所得固体的质量可能等于3.2g.故正确.
答案:D
点评 本题考查学生对常见金属的活动性的比较,金属的活动性顺序,分析实验现象和结果都是中考的热点,应要引起重视.

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案
相关题目
20.下列物质的用途与其化学性质不相关的是( )
| A. | 用二氧化碳灭火 | B. | 用液态氮气做制冷剂,保存血液 | ||
| C. | 用活性炭作净水剂 | D. | 用稀有气体作工业生产的保护气 |
18.实验室有一包铜粉和铁粉的混合粉末,为研究样品的组成.某同学取样品8.8g放入烧杯中,向烧杯中加入足量的硝酸银溶液,充分反应后过滤,洗涤干燥,称量固体质量为32.4g,问混合粉末中铜粉和铁粉的质量比为( )
| A. | 8:7 | B. | 7:8 | C. | 4:7 | D. | 1:2 |
4.下列四个图象,能正确反映其对应实验操作的是( )
| A. |  高温煅烧石灰石 | |
| B. |  用等质量、等质量分数的过氧化氢溶液制取氧气 | |
| C. |  向一定体积的稀盐酸中逐滴加入氢氧化钠溶液 | |
| D. |  某温度下,向一定量饱和硝酸钾溶液中加入硝酸钾晶体 |
1.日常生活中发生的下列变化,属于物理变化的是( )
| A. | 橘子榨成汁 | B. | 铁锅生锈 | C. | 酒精燃烧 | D. | 人的呼吸 |
2.向20℃的饱和澄清石灰水中投入适量的氧化钙粉末,充分反应,下列说法错误的是( )
| A. | 溶液温度未冷却到20℃时,一定是饱和溶液 | |
| B. | 溶液温度未冷却到20℃时,溶质质量分数比原溶液大 | |
| C. | 溶液温度恢复到20℃时,溶液质量比原溶液小 | |
| D. | 溶液温度恢复到20℃时,溶质质量分数和原溶液的相等 |
 用如图所示装置研究二氧化碳的性质.其中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.
用如图所示装置研究二氧化碳的性质.其中,①、④为用紫色石蕊溶液润湿的棉球,②、③为用石蕊溶液染成紫色的干燥棉球.