题目内容
5.黄铜是一种重要的金属,它是铜和锌的合金,可用来制造机器、电器零件及日常用品.为了测定黄铜样品的组成,取五份样品分别加稀硫酸反应,其实验数据记录如下:按要求回答下列问题:
(1)(4分)根据实验数据分析,表中m的数值为0.6,n的数值应该为1.0;
(2)(6分)列式计算该黄铜样品中金属铜的质量分数.(要求写出计算过程)
| 样品 | 第1份 | 第2份 | 第3份 | 第4份 | 第5份 |
| 取样品质量(g) | 40.0 | 40.0 | 40.0 | 40.0 | 40.0 |
| 取稀硫酸质量(g) | 30.0 | 60.0 | 90.0 | 120.0 | 150.0 |
| 产生气体质量(g) | 0.3 | m | 0.9 | 1.0 | n |
分析 (1)根据取样品都是40g时,硫酸质量是30g时,生成氢气0.3g,硫酸是90g时,生成氢气是0.9g,所以硫酸是60g时,生成氢气是0.6g,硫酸是120g时,生成氢气1.0g,所以硫酸是150g时,生成的氢气也是1.0g进行分析;
(2)根据生成氢气的质量计算出锌的质量,再用铜的质量除以样品的质量乘以百分之百即可.
解答 解:(1)取样品都是40g时,硫酸质量是30g时,生成氢气0.3g,硫酸是90g时,生成氢气是0.9g,所以硫酸是60g时,生成氢气是0.6g,硫酸是120g时,生成氢气1.0g,所以硫酸是150g时,生成的氢气也是1.0g,所以表中m的数值为0.6,n的数值应该为1.0,
故答案为:(1)0.6;1.0;
(2)设锌的质量为 x.
Zn+H2SO4═ZnSO4+H2↑
65 2
x 1g
$\frac{65}{2}=\frac{x}{1g}$
解得:x=32.5g
铜的质量分数为:$\frac{40g-32.5g}{40g}×100%=18.75%$,
答:该黄铜样品中铜的质量分数18.75%.
点评 解答本题关键是要通过图表中数据分析出最多生成氢气1.0g,再利用方程式计算出锌的质量,再进一步进行计算.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
13.在反应2A+3B═2C+4D中C、D的相对分子质量比为9:11.若2.2gA与一定质量的B恰好完全反应,生成4.4gD,则反应中B和D的质量比为( )
| A. | 10:11 | B. | 22:15 | C. | 15:22 | D. | 11:10 |
20.“东方之星”沉船事故救援中,潜水员所携带钢瓶中的气体主要是( )
| A. | 氢气 | B. | 氧气 | C. | 氮气 | D. | 二氧化碳 |
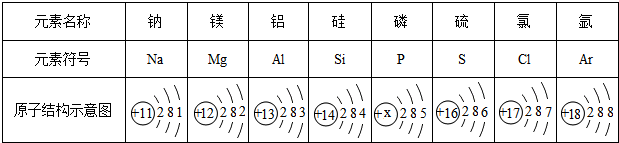
10.如表是元素周期表的一部分,表中三种元素的单质在通常情况下的状态是气态;氧原子的核外最外层电子数为6;等质量的氧气和氦气中,所含原子数较少的是氧气;在空气中占体积分数为78%的单质是N2(填分子式).
| 7 N 氦 14.00 | 8 O 氧 16.00 | 9 F 氟 19.00 |
17.下列实验进行中的现象或实验原理正确的是( )
| A. | 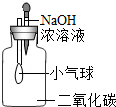 小气球变瘪 | B. |  U型管内液面左高右低 | ||
| C. | 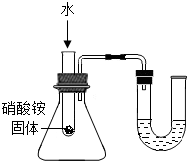 U型管内液面左高右低 | D. | 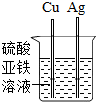 验证铁、铜和银金属活动性强弱 |
14.人们日常生活离不开金属,高科技新材料的开发和应用也需要金属.
(1)地壳中含量最高的金属元素是铝
(2)锂电池是一种新型的高能电池,其质量轻,电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应式为Li+MnO2=LiMnO2,其中化合价发生变化的元素是Li.Mn.
(3)根据如图金属应用实例推断,金属具有的物理性质有良好的导电性,良好的导热性
(4)日常使用的金属材料多数属于合金,如表列出了一些常见合金的主要成分和性能.由表推断,与组成合金的纯金属相比,合金的优点一般有(填序号)②④①强度更低;②硬度更高;③熔点更高;④抗腐蚀性更好.
(5)人们每年要从金属矿物资源中提取数以亿吨计的金属.根据所学化学知识,按要求写出一个生成金属的化学方程式:Fe+CuSO4═FeSO4+Cu.

(1)地壳中含量最高的金属元素是铝
(2)锂电池是一种新型的高能电池,其质量轻,电容量大,颇受手机、手提电脑等制造商的青睐.某种锂电池的总反应式为Li+MnO2=LiMnO2,其中化合价发生变化的元素是Li.Mn.
(3)根据如图金属应用实例推断,金属具有的物理性质有良好的导电性,良好的导热性
(4)日常使用的金属材料多数属于合金,如表列出了一些常见合金的主要成分和性能.由表推断,与组成合金的纯金属相比,合金的优点一般有(填序号)②④①强度更低;②硬度更高;③熔点更高;④抗腐蚀性更好.
| 合金 | 合金的主要性能 | 主要成分及纯金属的性能 |
| 焊锡 | 熔点183℃ | 锡:熔点232℃;铅:熔点327℃. |
| 硬铝 | 强度和硬度好 | 铝、铜、镁等.硬度小,质软. |
| 不锈钢 | 抗腐蚀性好 | 铁、铬、镍等.纯铁抗锈蚀性能不如不锈钢. |