题目内容
14. 图中甲、乙、丙是初中化学中常见的物质,图中“-”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去).下列说法中不正确的是( )
图中甲、乙、丙是初中化学中常见的物质,图中“-”表示相连的物质之间可以在溶液中发生化学反应,“→”表示由某种物质可转化为另一种物质(部分反应物、生成物及反应条件已略去).下列说法中不正确的是( )| A. | 甲、乙、丙可能依次为Fe、NaOH、CO2 | |
| B. | 丙物质可能是氧化物也可能是酸 | |
| C. | 当乙为NaOH时,它可由Ca(OH)2与Na2CO3反应生成 | |
| D. | 上述反应共涉及到置换、化合、复分解三种基本反应类型 |
分析 A、由图示可知,甲能与硫酸铜溶液、硫酸反应;乙能与硫酸铜、丙反应,氢氧化钙能转化为乙;丙能与乙、氢氧化钙反应;可以采用带入验证法进行验证.
B、丙能与乙、氢氧化钙反应,进行分析判断.
C、Ca(OH)2与Na2CO3反应生成碳酸钙沉淀和氢氧化钠,进行分析判断.
D、根据上述反应所涉及的基本反应类型,进行分析判断.
解答 解:A、由图示可知,甲能与硫酸铜溶液、硫酸反应;乙能与硫酸铜、丙反应,氢氧化钙能转化为乙;丙能与乙、氢氧化钙反应;Fe能与硫酸铜、硫酸反应;NaOH能与硫酸铜溶液反应,能与二氧化碳反应,能由氢氧化钙与碳酸钠反应制得;二氧化碳能与氢氧化钙反应;则甲、乙、丙可能依次为Fe、NaOH、CO2,故选项说法正确.
B、丙能与乙、氢氧化钙反应,乙为氢氧化钠等碱,酸与碱能发生中和反应,则丙物质可能是氧化物也可能是酸,故选项说法正确.
C、Ca(OH)2与Na2CO3反应生成碳酸钙沉淀和氢氧化钠,当乙为NaOH时,它可由Ca(OH)2与Na2CO3反应生成,故选项说法正确.
D、铁与硫酸铜溶液反应生成硫酸亚铁溶液和铜,酸与置换反应;Ca(OH)2与Na2CO3反应生成碳酸钙沉淀和氢氧化钠,酸与复分解反应;没有涉及化合反应;故选项说法错误.
故选:D.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4. 下列叙述不符合如图所示实验设计意图的是( )
下列叙述不符合如图所示实验设计意图的是( )
 下列叙述不符合如图所示实验设计意图的是( )
下列叙述不符合如图所示实验设计意图的是( )| A. | 说明一氧化碳具有还原性 | |
| B. | 说明生成物二氧化碳的密度比空气大 | |
| C. | 说明一氧化碳和氧化铜的反应需要加热 | |
| D. | 可以防止有毒的一氧化碳气体对空气的污染 |
19.化学兴趣小组的同学在整理课后实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
【提出问题2】该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】氯化钙溶液呈中性.
【实验探究2】
【实验结论】该氢氧化钠溶液部分(填“部分”或“全部”)变质.
【反思与评价】(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:CO2+2NaOH=Na2CO3+H2O.
(2)在上述【实验探究2】中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案不可行(填“可行”或“不可行”).原因是因为氢氧化钙与碳酸钠反应会生成氢氧化钠,这样无法确定(2)步骤的实验结论,得不出氢氧化钠部分变质的结论.
【提出问题1】该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实验操作 | 实验现象 | 实验结论 |
| 取少量该溶液于试管中,向溶液中滴加足量稀盐酸,并不断振荡. | 有气泡冒出 | 该反应的方程式为 2HCl+Na2CO3═2NaCl+H2O+CO2↑,由此可知该氢氧化钠溶液一定变质了. |
【猜想与假设】
猜想1:氢氧化钠溶液部分变质.
猜想2:氢氧化钠溶液全部变质.
【查阅资料】氯化钙溶液呈中性.
【实验探究2】
| 实验步骤 | 实验现象 | 实验结论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡. | 有白色沉淀 | 说明原溶液中一定有碳酸钠. 写出该反应的化学方程式CaCl2+Na2CO3=CaCO3↓+2NaCl. |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液. | 溶液变红色 | 说明原溶液中一定有氢氧化钠. |
【反思与评价】(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:CO2+2NaOH=Na2CO3+H2O.
(2)在上述【实验探究2】中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案不可行(填“可行”或“不可行”).原因是因为氢氧化钙与碳酸钠反应会生成氢氧化钠,这样无法确定(2)步骤的实验结论,得不出氢氧化钠部分变质的结论.
6.实验室需配制一定浓度的硝酸钾溶液.
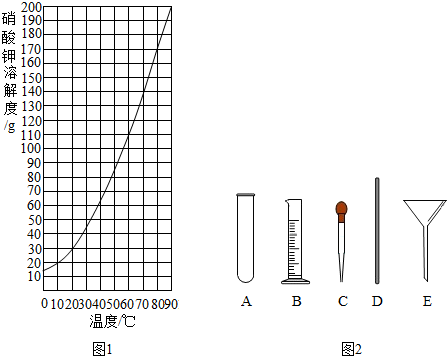
(1)查阅硝酸钾溶解性.由图可知,20℃时,硝酸钾的溶解度为31.6g,在该温度下配制硝酸钾溶液,溶质质量分数最大为24%(计算结果保留整数).
(2)计算.配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为4g,所需蒸馏水的体积为36mL
(3)称量.分别在天平左右两盘放上纸片,调节平衡后,A(填字母).
A.先移动游码到所需位置,再添加硝酸钾直到天平平衡
B.先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取.量取所需蒸馏水要用到的仪器是图2中的BC(填字母).
(5)溶解.将称量好的硝酸钾和蒸馏水混合溶解.
(6)稀释.20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出需要用到的数据:g/mL.
硝酸钾溶液的密度(单位g/mL)
(1)查阅硝酸钾溶解性.由图可知,20℃时,硝酸钾的溶解度为31.6g,在该温度下配制硝酸钾溶液,溶质质量分数最大为24%(计算结果保留整数).
(2)计算.配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为4g,所需蒸馏水的体积为36mL
(3)称量.分别在天平左右两盘放上纸片,调节平衡后,A(填字母).
A.先移动游码到所需位置,再添加硝酸钾直到天平平衡
B.先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取.量取所需蒸馏水要用到的仪器是图2中的BC(填字母).

(5)溶解.将称量好的硝酸钾和蒸馏水混合溶解.
(6)稀释.20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出需要用到的数据:g/mL.
硝酸钾溶液的密度(单位g/mL)
| 温度/℃ 质量分数/% | 20 | 40 | 60 |
| 4 | 1.023 | 1.016 | 1.007 |
| 10 | 1.063 | 1.054 | 1.044 |


 已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相对分子质量最小的氧化物,D物质很不稳定,容易分解生成B和C,它们之间的转化关系如下图所示.
已知A、E、F是单质,B、C、D是化合物,它们分别是由碳、氢、氧三种元素中的一种或者几种组成.其中B是相对分子质量最小的氧化物,D物质很不稳定,容易分解生成B和C,它们之间的转化关系如下图所示. 如图是某同学鉴别碳酸氢铵、硫酸铵、硝酸铵三种化肥的过程(反应条件未标出),请回答下列问题:
如图是某同学鉴别碳酸氢铵、硫酸铵、硝酸铵三种化肥的过程(反应条件未标出),请回答下列问题: