题目内容
19.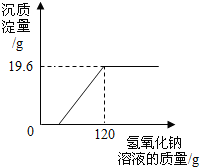 某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验.取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液.测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图.根据图中所得数据计算:
某环保小组监测到一湿法冶铜厂排放的废水中含有硫酸和硫酸铜两种污染物,为测定该废水中各污染物的含量,给冶铜厂提供处理废水的参考,环保小组的同学进行了以下实验.取废水500g,向其中加入溶质质量分数为20%的氢氧化钠溶液.测得沉淀质量与所加入的氢氧化钠溶液的质量关系如图.根据图中所得数据计算:(1)反应生成的Cu(OH)2的质量为19.6g;
(2)该废水中硫酸的溶质质量分数;(请写出计算过程)
(3)废水中所含硫酸的质量为9.8克;当加入120g氢氧化钠溶液反应后,求所得溶液中溶质的质量分数是7.1%(结果精确到0.1%).
分析 向含有硫酸和硫酸铜的溶液中加入氢氧化钠溶液,氢氧化钠先与硫酸进行反应,待硫酸完全反应时氢氧化钠继续与硫酸铜发生反应生成氢氧化铜蓝色沉淀;由反应图象中的曲线可得知恰好完全反应时生成沉淀19.6g时消耗氢氧化钠溶液的总质量为120g;根据氢氧化钠与硫酸铜反应的化学方程式,利用生成沉淀的质量可计算出反应所消耗氢氧化钠的质量;
加入的氢氧化钠总质量与形成沉淀所消耗的质量的差即为中和硫酸时所消耗的氢氧化钠,由此质量可根据反应的化学方程式计算出废水中硫酸的质量,最后利用硫酸质量与500g废水的质量比计算该废水中硫酸的溶质质量分数.
解答 解:(1)由图可知:反应生成的Cu(OH)2的质量为19.6g;故填:19.6;
(2)设与CuSO4反应的NaOH溶液的质量为x,生成硫酸钠的质量为y,
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
80 98 142
x×20% 19.6g y
$\frac{80}{x×20%}=\frac{98}{19.6g}=\frac{142}{y}$
x=80g,y=28.4g
设500g该废水中H2SO4的质量为z,生成硫酸钠的质量为m
H2SO4 +2NaOH=Na2SO4+2H2O
98 80 142
z (120g-80g)×20% m
$\frac{98}{z}=\frac{80}{(120g-80g)×20%}=\frac{142}{m}$
z=9.8g,m=14.2g
该废水中硫酸的溶质质量分数:$\frac{9.8g}{500g}×100%$=1.96%;
(3)废水中所含硫酸的质量为9.8g;
当加入120g氢氧化钠溶液反应后,求所得溶液中溶质的质量分数是:$\frac{28.4g+14.2g}{500g+120g-19.6g}×100%$=7.1%;
故填:9.8;7.1%
点评 对反应的图象中曲线进行分析,该曲线的起点表示硫酸被完全反应、折点表示硫酸铜与氢氧化钠恰好完全反应.

 阅读快车系列答案
阅读快车系列答案| A. | 通常物质燃烧的条件是:物质具有可燃性、跟氧气接触、温度达到可燃物的着火点,当这三个条件同时具备时燃烧才能发生 | |
| B. | 原子都是由质子、中子、电子三种微粒构成的 | |
| C. | 复分解反应的条件是:生成物有水、气体、沉淀三个条件至少满足一个,复分解反应才能发生 | |
| D. | 不同的物质构成它的基本微粒可能不同,分子、原子、离子都能构成物质 |
| A. | CaCl2 KNO3 Na2CO3 KCl | B. | NaCl BaCl2 Na2CO3 HCl | ||
| C. | Na2SO4 Ba(OH)2 Na2CO3 NaNO3 | D. | HNO3 Na2CO3 MgCl2 BaCl2 |
| A. | 滤渣中一定有镁粉 | B. | 滤渣中一定有铜和银 | ||
| C. | 滤液中一定有Mg2+ | D. | 滤液中一定有Ag+和Cu2+ |
| A. | 氧气液化变为淡蓝色液体 | |
| B. | 二氧化碳通入紫色的石蕊试液,试液变为红色 | |
| C. | 碘溶于酒精得到棕黄色溶液 | |
| D. | 高锰酸钾稀释后变为浅紫红色 |
| A. | 加热煮沸可以降低硬水的硬度 | |
| B. | 用肥皂水可以区分硬水和软水 | |
| C. | 水电解生成氢气和氧气,说明水中含有氢分子和氧分子 | |
| D. | 将雨水经沉降、过滤、吸附,灭菌等净化操作后,可供人们生活用水 |
| A. | 光合作用 | B. | 桂花飘香 | C. | 食品变质 | D. | 森林起火 |
 宜春温汤的富硒盐皮蛋因含硒而被大家熟知,皮蛋中含有丰富的蛋白质、脂肪、维生素和铁、钙、钾等人体所需要的矿物质元素.
宜春温汤的富硒盐皮蛋因含硒而被大家熟知,皮蛋中含有丰富的蛋白质、脂肪、维生素和铁、钙、钾等人体所需要的矿物质元素.