题目内容
15.科学家设想利用太阳能加热器“捕捉CO2”、“释放CO2”,实现碳循环.
(1)步骤1的化学方程式为CaO+CO2$\frac{\underline{\;400℃\;}}{\;}$CaCO3 .
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤为:取少量固体于试管中,滴加过量稀盐酸溶液,若观察到试管内有气泡产生.则分解不完全.
(3)上述设想的优点有AB(填字母序号).
A.原料易得且可循环利用 B.充分利用太阳能 C.可全地域全天候使用
(4)CO2是宝贵的碳氧资源.CO2和H2在一定条件下可合成甲酸(HCOOH),此反应中CO2与H2的分子个数比为1:1,若要检验1%甲酸水溶液是否显酸性,能选用的有BC(填字母序号)
A.无色酚酞溶液 B.紫色石蕊溶液 C.PH试纸
(5)请列举CO2的另一种用途可以用来灭火 它含量过高还容易引起的环境问题温室效应.
分析 (1)据化学方程式的书写方法解答;
(2)从碳酸盐检验方法去分析解答;
(3)A.上述设想中的原料是二氧化碳、氧化钙,原料易得,反应过程中二氧化碳和氧化钙既是步骤1的反应物,又是步骤2的生成物,可以循环使用去分析解答;
B.反应的反应条件是光照和加热,太阳能也能提供热量去分析解答;
C.从遮光的地方及阴天没有太阳时就不能反应去分析解答;
(4)根据方程式的书写及反应前后原子的个数不变分析;根据酸性物质与指示剂的关系选择;
(5)根据二氧化碳的性质分析其用途.
解答 解:(1)步骤1的化学方程式为:CaO+CO2$\frac{\underline{\;400℃\;}}{\;}$CaCO3 ;故答案为:CaO+CO2$\frac{\underline{\;400℃\;}}{\;}$CaCO3;
(2)碳酸钙属于碳酸盐,碳酸盐的检验可加入稀盐酸,如果有二氧化碳气体产生,说明含有碳酸盐;故答案为:稀盐酸;有气泡产生;
(3)①上述设想中的原料是二氧化碳、氧化钙,原料易得,反应过程中二氧化碳和氧化钙既是步骤1的反应物,又是步骤2的生成物,可以循环使用故①正确;
②反应的反应条件是光照和加热,太阳能也能提供热量;故②正确;
③遮光的地方及阴天没有太阳时就不能反应;故③错误;故答案为:AB;
(4)一分子的CO2和一分子的H2在一定条件下可合成一分子的甲酸(HCOOH),因此此反应中CO2与H2的分子个数比为1:1;酸性物质能够使紫色的石蕊试液变成红色,不能使酚酞试液变色,用pH试纸测定的pH<7,因此选择BC;故答案为:BC;
(5)因为二氧化碳不能燃烧,也不能支持燃烧,密度比空气大,故可以用来灭火;二氧化碳溶于水产生碳酸,可以制碳酸饮料等,另外还可以做制冷剂、人工降雨等;它含量过高容易引起的环境问题是温室效应;故答案为:可以用来灭火;温室效应;
点评 生活处处有化学,学会用化学知识解决生活中的实际问题,体会化学的奇妙.

 阶梯计算系列答案
阶梯计算系列答案 在盐酸和氢氧化钠溶液反应的过程中,如图是利用数字化传感器得到的溶液pH变化图象.据图分析能得出的结论正确的是( )
在盐酸和氢氧化钠溶液反应的过程中,如图是利用数字化传感器得到的溶液pH变化图象.据图分析能得出的结论正确的是( )| A. | a点对应的溶液的溶质只有NaCl,加入石蕊或酚酞都不变色 | |
| B. | b点表示稀盐酸和加入的NaOH溶液质量一定相同 | |
| C. | a到c的过程中,NaCl逐渐增加 | |
| D. | 反应进行到b点时放出的热量达到最大值 |
| 选项 | 物质 | 杂质 | 除杂试剂或方法 |
| A | KCl | MnO2 | 溶解、过滤、蒸发 |
| B | NaCl | Na2CO3 | 加入适量稀硫酸、蒸发 |
| C | Cu | CuO | 加入足量稀盐酸、过滤 |
| D | CaO | CaCO3 | 高温煅烧 |
| A. | A | B. | B | C. | C | D. | D |
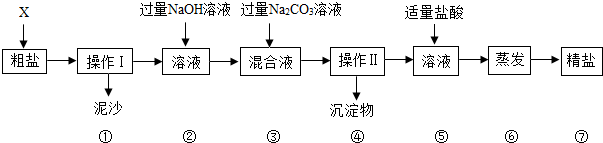
 最近,苏泊尔炊具锰超标的问题屡次被曝光,已引起国人普遍关注.锰是一种银白色、硬脆、有光泽的金属.工业上在高温条件下,用铝还原软锰矿(主要成分是MnO2)制得,同时生成氧化铝.锰是正常机体必需的微量元素之一,如果摄入量过多,会造成人体中枢神经系统的伤害,主要表现出精神病的症状,类似于帕金森综合症.
最近,苏泊尔炊具锰超标的问题屡次被曝光,已引起国人普遍关注.锰是一种银白色、硬脆、有光泽的金属.工业上在高温条件下,用铝还原软锰矿(主要成分是MnO2)制得,同时生成氧化铝.锰是正常机体必需的微量元素之一,如果摄入量过多,会造成人体中枢神经系统的伤害,主要表现出精神病的症状,类似于帕金森综合症.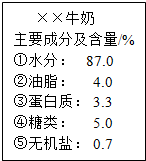 如图为某品牌牛奶的部分标签,请据此回答下列问题:
如图为某品牌牛奶的部分标签,请据此回答下列问题: 如图一是元素周期表中铁元素的相关信息,图二为某粒子结构示意图.试完成下列问题:
如图一是元素周期表中铁元素的相关信息,图二为某粒子结构示意图.试完成下列问题: