题目内容
7.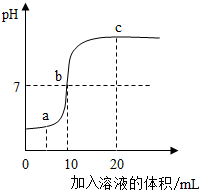 在盐酸和氢氧化钠溶液反应的过程中,如图是利用数字化传感器得到的溶液pH变化图象.据图分析能得出的结论正确的是( )
在盐酸和氢氧化钠溶液反应的过程中,如图是利用数字化传感器得到的溶液pH变化图象.据图分析能得出的结论正确的是( )| A. | a点对应的溶液的溶质只有NaCl,加入石蕊或酚酞都不变色 | |
| B. | b点表示稀盐酸和加入的NaOH溶液质量一定相同 | |
| C. | a到c的过程中,NaCl逐渐增加 | |
| D. | 反应进行到b点时放出的热量达到最大值 |
分析 A、根据A点pH<7,硫酸过量解答;
根据当溶液的pH<7时,溶液显酸性,当溶液的pH>7时,溶液显碱性,当溶液的pH=7时,溶液显中性解答;
B、根据M点溶液的pH=7,溶液为中性解答;
C、根据随着反应进行氯化钠质量不断增加分析;
D、根据中和反应放热回答.
解答 解:A、盐酸能与氢氧化钠反应生成氯化钠和水,当加入的溶液质量为ag时,溶液的pH小于7,显酸性,故溶液中除了氯化钠还有没参加反应的盐酸,故错;
B、b点溶液的pH=7,溶液为中性,表示酸碱恰好反应,稀盐酸和加入的NaOH溶液质量不一定相同,故错;
C、a到b的过程中,盐酸与氢氧化钠反应,NaCl逐渐增加,b到c的过程中,反应停止,NaCl不再增加,故错;
D、中和反应放热的,当B时,a到b的过程中,盐酸与氢氧化钠反应,不停放热,当b点时反应停止,不再放热,放出的热量达到最大值.故对;
故选:D.
点评 酸碱中和反应结合图象知识来考查,难度适中,考查的知识面较广.

练习册系列答案
相关题目
2.下列变化属于化学变化的是( )
| A. | 石蜡熔化 | B. | 铁锅生锈 | C. | 酒精挥发 | D. | 胆矾碾碎 |
19.甲同学误把H2O2溶液当作酸与Fe2O3粉末混合,发现有大量气泡产生.他联想到MnO2可作为H2O2分解的催化剂,那么,Fe2O3能否作为H2O2分解的催化剂呢?请你一起参与探究,并填写下列空白.
【猜想】Fe2O3能作为H2O2分解的催化剂.
【实验验证】甲同学依次设计了三个实验:
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃.说明H2O2溶液常温下缓慢分解.
实验二 在实验一的试管中加入W gFe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃.说明Fe2O3能加快H2O2的分解速率;
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g.说明反应前后Fe2O3的质量保持不变;
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂.
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验.探究反应前后Fe2O3的化学性质是否改变.
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出什么结论?相同条件下,MnO2的催化效果比Fe2O3好(或其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快).
用足量等体积H2O2溶液制取相同体积O2所需的时间:
【猜想】Fe2O3能作为H2O2分解的催化剂.
【实验验证】甲同学依次设计了三个实验:
实验一 取一定量的H2O2溶液于试管中,观察到有极少量气泡产生,伸入带火星的木条,没有复燃.说明H2O2溶液常温下缓慢分解.
实验二 在实验一的试管中加入W gFe2O3粉末,有大量气泡产生,然后伸入带火星的木条,木条复燃.说明Fe2O3能加快H2O2的分解速率;
实验三 待反应结束后,将试管里的不溶物滤出,并洗涤、干燥、称量,固体质量仍为W g.说明反应前后Fe2O3的质量保持不变;
【实验结论】甲同学认为,Fe2O3粉末可以作为H2O2分解的催化剂.
【反思评价】乙同学认为要证明甲同学的结论正确,仅做这三个实验还不充分,需要再补充一个探究实验.探究反应前后Fe2O3的化学性质是否改变.
【拓展】下表是丙同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出什么结论?相同条件下,MnO2的催化效果比Fe2O3好(或其他条件相同的情况下,H2O2浓度越大,产生氧气的速率越快).
用足量等体积H2O2溶液制取相同体积O2所需的时间:
| 时间(min) 浓度 催化剂 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
| 加入WgMnO2 | 0.2 | 0.8 | 2.0 |
| 加入WgFe2O3 | 7.0 | 9.0 | 16.0 |