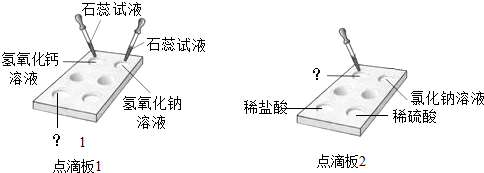
题目内容
17. 为了探究碳酸钠和石灰水是否恰好完全反应,某化学兴趣小组将其产物进行过滤,并对滤液进行如下探究.
为了探究碳酸钠和石灰水是否恰好完全反应,某化学兴趣小组将其产物进行过滤,并对滤液进行如下探究.[提出问题】所得滤液的溶质是什么?
[作出猜想]猜想Ⅰ:溶质是NaOH、Ca(OH)2
猜想Ⅱ:溶质是NaOH、Na2CO3
猜想Ⅲ:溶质是NaOH.你做出猜想Ⅲ的理由是二者恰好完全反应.
【实验过程】
| 实验操作 | 实验现象 | 试验结论 |
| ①取少量滤液于试管中,滴加过量稀盐酸 | 无气泡产生 | 猜想Ⅱ不成立 |
| ②取少量滤液于试管中,滴加Na2CO3溶液 | 有沉淀生成 | 猜想成立.反应的化学方程式是Na2CO3+Ca(OH)2═CaCO3↓+2NaOH |
[定量研究]称取20g烧碱固体样品(样品中的杂质四碳酸钠),配成溶液,然后向溶液中加入稀盐酸,产生二氧化碳的量如图所示.试计算样品中氢氧化钠的质量分数(写出计算过程).
分析 [作出猜想]对反应后溶液中的物质进行假设,从两个方面来思考,一是恰好完全反应,二是有一种反应物过量,不可能两种反应物都过量;
【实验过程】根据碳酸根离子的检验方法来分析;根据检验氢氧化钙是否存在的方法来分析实验过程;
[拓展反思]可以用二氧化碳气体来检验氢氧化钙的存在;
[定量研究]含碳酸钠杂质的氢氧化钠样品中加入稀盐酸,首先发生的是酸碱中和反应,其次才发生碳酸钠和盐酸的反应;根据生成的二氧化碳的质量计算出碳酸钠的质量,并进一步得出其中氢氧化钠的含量.
解答 解:[作出猜想]当二者恰好完全反应时,溶液中的溶质只有氢氧化钠;故填:NaOH;二者恰好完全反应;
【实验过程】①加入稀盐酸后,没有气泡产生,说明反应后的溶液中没有碳酸钠的存在;故猜想Ⅱ不成立;
②检验是否是氢氧化钙过量,可以加入碳酸钠溶液,若有白色沉淀生成,则证明溶液中含有氢氧化钙,因为氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠;
故填:Na2CO3;有沉淀生成;Na2CO3+Ca(OH)2═CaCO3↓+2NaOH;
[拓展反思]因为二氧化碳能使澄清的石灰水变浑浊,所以还可以通入二氧化碳气体来检验;故填:CO2;
【定量研究】解:设含碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g
$\frac{106}{44}=\frac{x}{4.4g}$
x=10.6g
则其中氢氧化钠的质量分数为:$\frac{20g-10.6g}{20g}×100%$=47%
答:样品中氢氧化钠的质量分数为47%.
点评 此题是有关反应后溶液中成分的探究题,其中又有根据方程式的计算题,步骤较多,做题过程比较繁琐,属于较难题型.


| A. | 图④是水分子的模型图 | B. | 该反应前后元素种类没有改变 | ||
| C. | 图①中氮、氢两元素的质量比为1:3 | D. | 该反应一共涉及了四种物质 |
(1))MnO2催化H2O2分解的化学方程式是2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$O2↑+2H2O.
(2)甲小组有如表实验设计方案,则该实验的目的是探究浓度对H2O2分解速率的影响.
| 实验编号 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 25℃ | 二氧化锰 | 10mL 2%H2O |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O |
①其他条件相同的情况下,浓度越大,H2O分解速率越快.
②其他条件相同的情况下,H2O在碱(填“酸”或“碱”)性环境下放出气体速率较快.

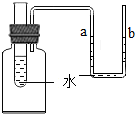 如图所示,向小试管中分别加入一定量的下列物质,右侧U型管中的液面随即发生明显的变化,则加入的物质不会是( )
如图所示,向小试管中分别加入一定量的下列物质,右侧U型管中的液面随即发生明显的变化,则加入的物质不会是( )| A. | 硝酸铵固体 | B. | 烧碱固体 | C. | 食盐固体 | D. | 生石灰固体 |
| A. | 空气中氧气主要来自植物的光合作用 | |
| B. | 在工业上氧气可以用来炼钢 | |
| C. | 通常情况下,空气中氧气的质量分数约为21% | |
| D. | 氧气供给呼吸,它和体内物质反应,释放能量,维持生命活动的需要 |