题目内容
11.下水道堵塞是日常生活中经常遇到的问题,“管道通”可使堵塞的管道畅通无阻,某同学对此很好奇,于是想探究“管道通”中物质的成分,请与该同学一起探究:【提出问题】“管道通”中的物质是什么?
【查阅资料】
(1)下水管里的淤积物主要为油污、食物残渣、毛发等.
(2)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西.常用于疏通管道.
(3)铝粉呈银灰色.铝与酸、强碱溶液都能反应放出氢气,同时放出大量热.
①铝与盐酸反应的化学方程式是2Al+6HCl═2AlCl3+3H2↑.
②铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑
【猜想与验证】打开一盒管道通,内有一袋白色固体颗粒和一袋银灰色粉末.
(1)猜想:白色固体颗粒为氢氧化钠.
| 实验操作 | 实验现象 |
| ①将几粒白色颗粒放在玻璃片上,放置一会儿. | 白色颗粒潮解 |
| ②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁. | 试管外壁发烫 |
| ③向步骤②得到的溶液中放入一段羊毛线,加热一段时间. | 羊毛线逐渐消失 |
(2)猜想:银灰色粉末为铝粉.
实验:取该粉末分别置于两支洁净的试管中,向一只试管中滴加稀盐酸,另一只中滴加氢氧化钠溶液,都产生大量气泡且试管外壁温度明显升高,点燃反应产生的气体火焰均呈淡蓝色.
结论:银灰色粉末为铝粉.
【应用】使用“管道通”时,先将银灰色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口.管道内可能出现的现象是ABCD.
A.管道内温度明显升高 B.产生大量气体
C.反应放出大量热 D.气体燃烧后,火焰成淡蓝色.
分析 【查阅资料】
铝和稀盐酸反应生成氯化铝和氢气;
反应前后元素的种类不变,原子的种类、总个数不变;
【猜想与验证】
氢氧化钠溶于水能够放出大量的热;
【应用】铝、氢氧化钠、水反应时放出大量的热,生成氢气,氢气燃烧时发出淡蓝色的火焰.
解答 解:【查阅资料】
(3)①铝与盐酸反应的化学方程式是:2Al+6HCl═2AlCl3+3H2↑.
故填:2Al+6HCl═2AlCl3+3H2↑.
②根据质量守恒定律可知,反应物比生成物中缺少4个氢原子和2个氧原子,所以缺少的反应物应该是水,水分子前面的化学计量数是2.
故填:2H2O.
【猜想与验证】
(1)氢氧化钠暴露在空气中容易潮解,固体氢氧化钠溶于水时能够放出大量的热.
故填:白色颗粒潮解;试管外壁发烫.
(2)铝既能够与酸反应,又能够与碱反应,所以向一只试管中滴加稀盐酸,另一只中滴加的应该是显碱性的溶液,氢氧化钠溶液显碱性.
故填:氢氧化钠.
【应用】
氢氧化钠溶于水时放出大量的热,管道内温度明显升高;
铝和氢氧化钠溶液反应时能够生成氢气,同时放出大量的热;
氢气燃烧时,火焰是淡蓝色的.
故填:ABCD.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
1.锌及其氧化物(ZnO,白色,难溶于水,溶于强酸)具有广泛的应用.
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致“侏儒 症”和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑.
(3)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
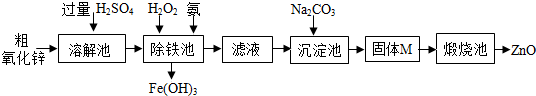
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:
【查阅资料】一些阳离子以氢氧化物形式开始沉淀、完全沉淀时溶液的pH见上表.
【问题探究】
(4)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,使其充分反应.
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为1.5~3.2.
(6)“沉淀池”中的沉淀经过滤、洗涤等操作得纯净固体M,其组成为:aZnCO3•bZn(OH)2•cH2O.
确认固体M已经洗涤干净的操作是:取最后一次洗涤液,最好选择下列C,
向其中滴入无现象,则已经洗干净.
A.紫色石蕊试液 B.少量稀盐酸 C.氯化钡溶液或硝酸钡溶液空气
组成测定固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):
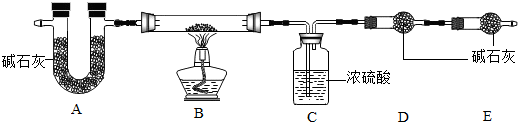
【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(7)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+(b+c)H2O+aCO2↑.
ZHEN现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(8)装置A的作用是除去空气中的H2O和CO2.
(9)根据上述数据,则生成ZnO的质量为24.3g;a:b:c=1:2:2.
(10)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
(一)锌的广泛应用
(1)锌被称之为“生命元素”.儿童、青少年如果缺锌严重,将会导致“侏儒 症”和智力发育不良.经常吃贝壳类海产品、红色肉类等含锌的食物有利补“锌”.这里的“锌”是指B.
A.单质 B.元素 C.原子 D.分子
(2)实验室用锌与稀硫酸制取氢气,反应的化学方程式为Zn+H2SO4═ZnSO4+H2↑.
(3)锌与铜熔合可形成“黄铜”,它属于A(选填序号).
A.金属材料 B.无机非金属材料 C.合成材料 D.复合材料
(二)活性ZnO制取的探究
【实验方案】工业上用粗氧化锌(含少量FeO)制取活性氧化锌,其流程如下:

| 沉淀物 | Fe(OH)3 | Zn(OH)2 | Fe(OH)2 |
| 开始沉淀pH | 1.5 | 6.2 | 6.3 |
| 完全沉淀pH | 3.2 | 8.0 | 9.7 |
【问题探究】
(4)“溶解”前将粗氧化锌粉碎成细颗粒,目的是增大接触面积,使其充分反应.
(5)“溶解”后得到的酸性溶液中含有ZnSO4、H2SO4、FeSO4.除铁池中加入适量H2O2,使Fe2+转化为Fe3+;为使溶液中Fe3+全部转化为Fe(OH)3,而Zn2+不形成Zn(OH)2,则应加入氨水控制溶液的pH的范围为1.5~3.2.
(6)“沉淀池”中的沉淀经过滤、洗涤等操作得纯净固体M,其组成为:aZnCO3•bZn(OH)2•cH2O.
确认固体M已经洗涤干净的操作是:取最后一次洗涤液,最好选择下列C,
向其中滴入无现象,则已经洗干净.
A.紫色石蕊试液 B.少量稀盐酸 C.氯化钡溶液或硝酸钡溶液空气
组成测定固体B的组成会影响制得的ZnO的活性.为确定aZnCO3•bZn(OH)2•cH2O的组成,进行如下实验(假设每步反应、吸收均完全):

【查阅资料】aZnCO3•bZn(OH)2•cH2O受热分解生成ZnO、H2O、CO2三种产物.
(7)写出装置B中发生反应的化学方程式aZnCO3•bZn(OH)2•cH2O$\frac{\underline{\;\;△\;\;}}{\;}$(a+b)ZnO+(b+c)H2O+aCO2↑.
ZHEN现称取35.9g aZnCO3•bZn(OH)2•cH2O在B装置中进行完全煅烧,测得装置C和D的质量分别增重7.2g和4.4g.
【实验分析及数据处理】
(8)装置A的作用是除去空气中的H2O和CO2.
(9)根据上述数据,则生成ZnO的质量为24.3g;a:b:c=1:2:2.
(10)若没有E装置,则测得的a值偏大(填“偏大”、“偏小”或“不变”).
2.下列鉴别物质所用的方法或试剂错误的是( )
| A. | 二氧化碳和氮气--观察颜色 | |
| B. | 铁粉和炭粉--用稀硫酸 | |
| C. | 热塑性塑料和热固性塑料--加热观察外形变化 | |
| D. | 氢氧化钙溶液和水--用酚酞溶液 |
19.如图是几种粒子的结构示意图,有关说法正确的是( )


| A. | ③和④属于同种元素 | B. | ③表示阴离子 | ||
| C. | ①属于金属元素 | D. | ②属于稀有气体元素 |
16. 常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )
常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )
 常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )
常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )| A. | 常温时,该物质的溶解度是40g | |
| B. | D点时,该溶液已达到饱和状态 | |
| C. | 加溶质,能使A点状态的溶液变化到C点状态 | |
| D. | 图中各处溶液的溶质质量分数由小到大是A、B、C |
3.下列事实的结论或解释中不正确的是( )
| A. | 真金不怕火炼--说明金的熔点高 | |
| B. | 一滴水中大约有1.67×1021个水分子--说明分子很小 | |
| C. | 盐酸、硫酸均能使石蕊溶液变红一一二者溶液中都含有H+ | |
| D. | 变瘪的乒乓球放入热水中能鼓起来--说明温度升高,分子间的间隔会变大 |
20.同学们在实验室用混合两种固体药品的办法自制“钾、氮复合肥”,使用到的药品有KCl,K2SO4,NH4HCO3,NH4Cl.同学们制得了成分不同的“钾、氮复合肥”,从中抽取一份作为样品探究其成分,请回答有关问题:限选试剂:稀盐酸,稀硫酸,BaCl2溶液,AgNO3溶液,蒸馏水
(1)提出合理假设.所抽样品的成分共有4种可能:
假设1:KCl和NH4HCO3;
假设2:KCl和NH4Cl;
假设3:K2SO4和NH4HCO3;
假设4:K2SO4和NH4Cl.
(2)形成设计思路.
①甲同学提出先用AgNO3溶液确定是否含有KCl,你是否同意?其理由是什么?不同意,因为氯化铵和硝酸银反应也能够生成白色沉淀氯化银.
②乙同学提出先确定是否含有NH4HCO3,则可以选择的试剂是稀盐酸或稀硫酸.
(3)【完成实验方案】请填写实验操作及与表中结论相符的预期现象.
(1)提出合理假设.所抽样品的成分共有4种可能:
假设1:KCl和NH4HCO3;
假设2:KCl和NH4Cl;
假设3:K2SO4和NH4HCO3;
假设4:K2SO4和NH4Cl.
(2)形成设计思路.
①甲同学提出先用AgNO3溶液确定是否含有KCl,你是否同意?其理由是什么?不同意,因为氯化铵和硝酸银反应也能够生成白色沉淀氯化银.
②乙同学提出先确定是否含有NH4HCO3,则可以选择的试剂是稀盐酸或稀硫酸.
(3)【完成实验方案】请填写实验操作及与表中结论相符的预期现象.
| 实验操作 | 预期现象 | 结论 |
| 步骤1:取少量固体于试管中,滴加适量的稀盐酸或稀硫酸 | 不产生气泡 | 假设2成立 |
| 步骤2:另取少量固体于另一支试管中,加足量的水溶解,滴加适量的氯化钡溶液 | 不产生白色沉淀 |
1.某同学的如下几种操作,正确的是( )
| A. |  | B. |  | C. |  | D. |  |
