题目内容
16. 常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )
常温时,该物质在不同质量的水中溶解达到饱和状态,溶质的质量与水的质量关系如图所示,下列说法错误的是( )| A. | 常温时,该物质的溶解度是40g | |
| B. | D点时,该溶液已达到饱和状态 | |
| C. | 加溶质,能使A点状态的溶液变化到C点状态 | |
| D. | 图中各处溶液的溶质质量分数由小到大是A、B、C |
分析 A、此图象是常温时物质的溶解情况,以及该温度下的溶解度;
B、根据饱和溶液的定义分析;
C、不饱和溶液与饱和溶液的转化分析解答;
D、图中四点的含义分别是A点:80g水中溶解20g溶质的不饱和溶液;B点:100g水中溶解20g溶质的不饱和溶液;C点是100g水中溶解40g溶质的饱和溶液;D点:这一温度下的饱和溶液,利用这些相关知识分析解答.
解答 解:A、此图象是常温时物质的溶解情况,以及该温度下的溶解度是40g,故正确;
B、点D是该温度下的饱和溶液,故正确.
C、A点:80g水中溶解20g溶质的不饱和溶液,C点是100g水中溶解40g溶质的饱和溶液,所以加溶质,能使A点状态的溶液变化到C点状态,故正确;
D、图中四点的含义分别是A点:80g水中溶解20g溶质的不饱和溶液;B点:100g水中溶解20g溶质的不饱和溶液;C点是100g水中溶解40g溶质的饱和溶液;D点:这一温度下的饱和溶液,所以质量分数C=D>B>A,故错误;
故选:C.
点评 此题是对溶液知识的考查,解题的关键是对图象知识的掌握与了解,然后结合溶解度概念、溶质的质量分数等知识分析解答.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.某小组同学用盐酸和氢氧化钙进行酸和碱中和反应的探究.
(1)甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由红色变为无色.结论:两种物质发生了反应.反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O.
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二有CaCl2和HCl;猜想三,有CaCl2和Ca(OH)2
[查阅资料]CaCl2溶液为中性.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
[实验结论]丙认为猜想二正确.
[实验评价]丙认为方案1的实验操作和方案二的设计中有不足之处,请任选其一说明其不足之处是方案1中使用pH试纸的操作不对.
大家讨论后方案3可证明猜想二正确,其实验中应观察到的现象为先有气体产生,后有白色沉淀生成.
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
(2)请根据如图所示的实验过程和提供的数据(步骤②产生的气体全部逸出),计算实验后所得CaCl2溶液的溶质的质量分数(写出计算过程)

(1)甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由红色变为无色.结论:两种物质发生了反应.反应的化学方程式为Ca(OH)2+2HCl=CaCl2+2H2O.
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二有CaCl2和HCl;猜想三,有CaCl2和Ca(OH)2
[查阅资料]CaCl2溶液为中性.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
| 方案编号 | 方案1 | 方案2 | 方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) | 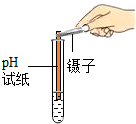 | 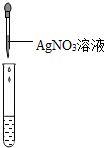 | 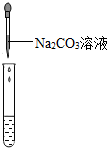 |
| 实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
[实验评价]丙认为方案1的实验操作和方案二的设计中有不足之处,请任选其一说明其不足之处是方案1中使用pH试纸的操作不对.
大家讨论后方案3可证明猜想二正确,其实验中应观察到的现象为先有气体产生,后有白色沉淀生成.
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
| 要分离的盐 | 所用试剂 | 主要操作 |
| CaCl2、NaCl | Na2CO3,HCl | 混合物中加入Na2CO3溶液至不再产生沉淀,过滤,将滤液蒸发即得NaCl;将过滤后的固体加稀盐酸至不再产生气体,对溶液加热蒸发即得CaCl2 |

11.下水道堵塞是日常生活中经常遇到的问题,“管道通”可使堵塞的管道畅通无阻,某同学对此很好奇,于是想探究“管道通”中物质的成分,请与该同学一起探究:
【提出问题】“管道通”中的物质是什么?
【查阅资料】
(1)下水管里的淤积物主要为油污、食物残渣、毛发等.
(2)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西.常用于疏通管道.
(3)铝粉呈银灰色.铝与酸、强碱溶液都能反应放出氢气,同时放出大量热.
①铝与盐酸反应的化学方程式是2Al+6HCl═2AlCl3+3H2↑.
②铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑
【猜想与验证】打开一盒管道通,内有一袋白色固体颗粒和一袋银灰色粉末.
(1)猜想:白色固体颗粒为氢氧化钠.
结论:白色固体颗粒为氢氧化钠.
(2)猜想:银灰色粉末为铝粉.
实验:取该粉末分别置于两支洁净的试管中,向一只试管中滴加稀盐酸,另一只中滴加氢氧化钠溶液,都产生大量气泡且试管外壁温度明显升高,点燃反应产生的气体火焰均呈淡蓝色.
结论:银灰色粉末为铝粉.
【应用】使用“管道通”时,先将银灰色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口.管道内可能出现的现象是ABCD.
A.管道内温度明显升高 B.产生大量气体
C.反应放出大量热 D.气体燃烧后,火焰成淡蓝色.
【提出问题】“管道通”中的物质是什么?
【查阅资料】
(1)下水管里的淤积物主要为油污、食物残渣、毛发等.
(2)氢氧化钠是强碱,能去除油污,腐蚀毛发一类的东西.常用于疏通管道.
(3)铝粉呈银灰色.铝与酸、强碱溶液都能反应放出氢气,同时放出大量热.
①铝与盐酸反应的化学方程式是2Al+6HCl═2AlCl3+3H2↑.
②铝与氢氧化钠溶液反应的化学方程式是2Al+2NaOH+2H2O═2NaAlO2+3H2↑
【猜想与验证】打开一盒管道通,内有一袋白色固体颗粒和一袋银灰色粉末.
(1)猜想:白色固体颗粒为氢氧化钠.
| 实验操作 | 实验现象 |
| ①将几粒白色颗粒放在玻璃片上,放置一会儿. | 白色颗粒潮解 |
| ②将几粒白色颗粒放入盛有少量水的试管中,并用手触摸试管外壁. | 试管外壁发烫 |
| ③向步骤②得到的溶液中放入一段羊毛线,加热一段时间. | 羊毛线逐渐消失 |
(2)猜想:银灰色粉末为铝粉.
实验:取该粉末分别置于两支洁净的试管中,向一只试管中滴加稀盐酸,另一只中滴加氢氧化钠溶液,都产生大量气泡且试管外壁温度明显升高,点燃反应产生的气体火焰均呈淡蓝色.
结论:银灰色粉末为铝粉.
【应用】使用“管道通”时,先将银灰色粉状固体添加入被堵塞的管道中,再加入白色固体颗粒,倒入一杯水,堵上管道口.管道内可能出现的现象是ABCD.
A.管道内温度明显升高 B.产生大量气体
C.反应放出大量热 D.气体燃烧后,火焰成淡蓝色.
1. 向稀盐酸和硫酸铜的混合溶液中逐滴滴入X溶液至过量,生成沉淀的质量随滴入溶液质量的变化关系如图所示.则X可能是( )
向稀盐酸和硫酸铜的混合溶液中逐滴滴入X溶液至过量,生成沉淀的质量随滴入溶液质量的变化关系如图所示.则X可能是( )
 向稀盐酸和硫酸铜的混合溶液中逐滴滴入X溶液至过量,生成沉淀的质量随滴入溶液质量的变化关系如图所示.则X可能是( )
向稀盐酸和硫酸铜的混合溶液中逐滴滴入X溶液至过量,生成沉淀的质量随滴入溶液质量的变化关系如图所示.则X可能是( )| A. | 硝酸银溶液 | B. | 氯化钡溶液 | C. | 硝酸钾溶液 | D. | 氢氧化钠溶液 |
8.“饮食健康”是人们普遍的生活追求,下列说法正确的是( )
| A. | 过量摄入油脂会使人发胖,应禁止食用油脂 | |
| B. | 海鲜产品从沿海运到衡阳过程中可以喷洒甲醛溶液防腐 | |
| C. | 在煲好的鸡汤中放入适量的加碘食盐 | |
| D. | 为了保持香肠肉质鲜美,添加过量的亚硝酸钠 |
5. 如图所示是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是( )
如图所示是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是( )
 如图所示是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是( )
如图所示是甲、乙两种固体物质的溶解度曲线.下列说法中正确的是( )| A. | 甲物质的溶解度大于乙物质的溶解度 | |
| B. | t2℃时,向甲的饱和溶液中加入少量水,甲的溶解度变小 | |
| C. | 乙物质的饱和溶液从t2℃降到t1℃时,溶液中溶质的质量分数保持不变 | |
| D. | t2℃时,甲、乙两物质各50g,分别充分溶解于100g水中,得到的溶液质量分数相同 |