题目内容
12. 老师用如图所示装置为同学们做如下实验:A装置集气瓶中装有体积比约为1:1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量生锈的铁钉;D装置中盛有足量的稀硫酸.
老师用如图所示装置为同学们做如下实验:A装置集气瓶中装有体积比约为1:1的氮气和气体a的混合气体,注射器中装有足量的无色溶液b;B装置中盛有少量紫色石蕊溶液;C装置中盛有适量生锈的铁钉;D装置中盛有足量的稀硫酸.(1)关闭活塞K1、K2,将注射器中的溶液b挤入瓶中,打开活塞K1,看到B中溶液进入A中后溶液变为蓝色,B中长导管脱离液面.请回答:
①若a气体是二氧化碳,则b是NaOH溶液(填化学式).
②若b是水,则气体a可能是NH3(填化学式).
(2)保持K1开启状态,并打开K2,一段时间后关闭K2,整个过程中,观察到D中的现象是AB;写出C装置中反应的化学方程式是Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe+H2SO4=FeSO4+H2↑
A.广口瓶内液面下降 B.长颈漏斗内液面上升 C.长颈漏斗下端有气泡.
分析 (1)根据B中溶液进入A中后溶液变为蓝色,说明气体与溶液b反应造成气压降低,且生成了碱性物质进行分析;
(2)由A装置内气压较小,导致B装置内气压也减小,在外界大气压的作用下再分析题目.
解答 解:(1)B中溶液进入A中后溶液变为蓝色,说明气体与溶液b反应造成气压降低,且生成了碱性物质;
①若a气体是二氧化碳,则b必须是能与二氧化碳反应的物质,故可能是氢氧化钠溶液;
②若b是水,则气体a应易溶于水,且溶于水后呈碱性,因此a可能是氨气.
(2)由于A装置中的气体与溶液反应,造成气压减小,B中液体进入A,C中气体进入B,故D中的稀硫酸进入装置C,然后与生锈的铁钉发生反应,反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;Fe+H2SO4=FeSO4+H2↑,由于氢气的生成,气压升高,故长颈漏斗中的液面上升.
故答案为:(1)①NaOH;②NH3;(2)AB;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O、Fe+H2SO4=FeSO4+H2↑.
点评 通过回答本题可知有些题目需要结合物理知识来回答,并且利用外界大气压与瓶内的压力差来做题.

练习册系列答案
相关题目
9.“数字化实验”丰富了实验研究的方法,它可将实验过程中某些因素(酸碱性、气压等)的变化以数据、图象的形式呈现出来.请回答:
Ⅰ.探究二氧化碳与水的反应
①图1中可观察到甲试管中的紫色液体变为红色,写出发生反应的化学方程式CO2+H2O→H2CO3,乙试管的作用是对照;
②由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变强(填“强”或“弱”).
Ⅱ.探究蜡烛燃烧的产物
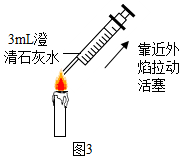
③如图3所示,用注射器在蜡烛外焰部位抽气并振荡,可观察到石灰水变浑浊,证明反应生成了二氧化碳;若将干冷的烧杯罩在火焰上方,观察到烧杯内壁有水雾,证明反应生成了水.
④如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示,曲线b、c(选填“a”、“b”、“c”)能够说明蜡烛燃烧生成了二氧化碳和水.
Ⅱ.比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度
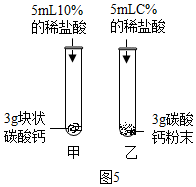
⑤写出碳酸钙与稀盐酸发生反应的化学方程式CaCO3+2HCl→CaCl2+H2O+CO2↑;
图5中,乙试管中稀盐酸的浓度C%应为10%;
较之块状碳酸钙,碳酸钙粉末与稀盐酸的反应更为剧烈,原因是反应物之间的接触面积更大.
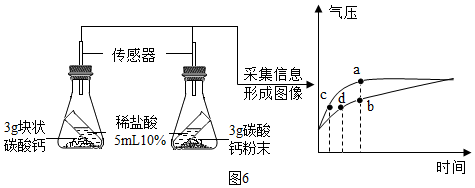
⑥按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示.对比分析坐标图中的点c、d(选填a~d)可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短.
Ⅰ.探究二氧化碳与水的反应
| 方案一 | 方案二(数字化实验) |
 | 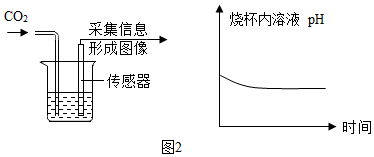 |
②由图2坐标图中的曲线可知,烧杯内溶液的酸性逐渐变强(填“强”或“弱”).
Ⅱ.探究蜡烛燃烧的产物
| 方案一 | 方案二(数字化实验) |
 |  |
④如图4所示,蜡烛在密闭容器内燃烧,同时监测容器内氧气、二氧化碳和水蒸气含量的变化,形成三条曲线如坐标图所示,曲线b、c(选填“a”、“b”、“c”)能够说明蜡烛燃烧生成了二氧化碳和水.
Ⅱ.比较块状碳酸钙、碳酸钙粉末与稀盐酸反应的速度
⑤写出碳酸钙与稀盐酸发生反应的化学方程式CaCO3+2HCl→CaCl2+H2O+CO2↑;
| 方案一 | 方案二(数字化实验) |
 |  |
较之块状碳酸钙,碳酸钙粉末与稀盐酸的反应更为剧烈,原因是反应物之间的接触面积更大.
⑥按图6所示进行实验,倾斜锥形瓶使小试管内的稀盐酸流入瓶中与固体接触发生反应,瓶内气压的变化如坐标图所示.对比分析坐标图中的点c、d(选填a~d)可知:两个锥形瓶内达到相同的压强时,碳酸钙粉末与稀盐酸反应所需时间更短.
3. 为测定某含杂质铜的锌样品中锌的质量分数,取样品20克装入一容器,再取稀硫酸200克,平均分成4份并分4次加入容器中,测定生成气体的总质量,结果如下表:
为测定某含杂质铜的锌样品中锌的质量分数,取样品20克装入一容器,再取稀硫酸200克,平均分成4份并分4次加入容器中,测定生成气体的总质量,结果如下表:
(1)m=0.4g;
(2)20克样品与稀硫酸反应最多产生氢气是0.6g;
(3)计算样品中锌的质量分数是多少?(写出计算过程)
(4)画出生成气体质量与所加稀硫酸的关系曲线图.
 为测定某含杂质铜的锌样品中锌的质量分数,取样品20克装入一容器,再取稀硫酸200克,平均分成4份并分4次加入容器中,测定生成气体的总质量,结果如下表:
为测定某含杂质铜的锌样品中锌的质量分数,取样品20克装入一容器,再取稀硫酸200克,平均分成4份并分4次加入容器中,测定生成气体的总质量,结果如下表:| 稀盐酸的质量 | 第一次50g | 第二次50g | 第三次50g | 第四次50g |
| 生成气体总质量 | 0.2g | m | 0.6g | 0.6g |
(2)20克样品与稀硫酸反应最多产生氢气是0.6g;
(3)计算样品中锌的质量分数是多少?(写出计算过程)
(4)画出生成气体质量与所加稀硫酸的关系曲线图.
20.下列变化中前者是化学变化,后者是物理变化的是( )
| A. | 食盐溶于水,火药爆炸 | B. | 镁带燃烧,铁生锈 | ||
| C. | 食物腐败,水结成冰 | D. | 铁丝被拉长,电灯发光 |
17.工业上常利用电石制乙炔气体(C2H2)时产生的灰浆和残渣制备化工原料KClO3和超细CaCO3.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
上述流程中加入KCl粉末,KCl与Ca(ClO3)2(填化学式)发生了复分解反应,得到KClO3晶体.你认为能得到KClO3晶体的原因是KClO3在常温下溶解度较小.
(4)洗涤时,可选用下列洗涤剂BC(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
(1)电石制乙炔气体(C2H2)时产生灰浆和残渣的过程如下:电石(CaC2)$\stackrel{水}{→}$灰浆$\stackrel{露置于空气}{→}$残渣
其中电石与水反应生成氢氧化钙和乙炔,写出该反应的化学方程式CaC2+2H2O=Ca(OH)2+C2H2↑.残渣中主要成分是Ca(OH)2和CaCO3.
Ⅰ.制备KClO3的流程如图:

(2)向灰浆浊液中通入Cl2,得到Ca(ClO3)2、CaCl2溶液.反应中Ca(ClO3)2与CaCl2的化学计量数分别为1和5.写出此反应的化学方程式6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O.
(3)有关物质在常温下的溶解度如下:
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| 溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
(4)洗涤时,可选用下列洗涤剂BC(填字母编号).
A.KCl饱和溶液 B.冰水 C.饱和KClO3溶液
Ⅱ.制备超细CaCO3的流程如下(注:加入NH4Cl溶液的目的是溶解残渣中的难溶盐):

(5)向CaCl2溶液中通入两种气体,生成超细CaCO3的化学方程式CaCl2+2NH3+CO2+H2O=CaCO3↓+2NH4Cl.检验CaCO3是否洗涤干净的方法是取最后一次的洗涤液加硝酸银溶液,如有沉淀生成则没有洗干净,反之以洗干净.
(6)流程中溶液A可循环使用,其主要成分的化学式是NH4Cl.
1.下列有关CO2用途,既利用其物理性质又利用其化学性质的是( )
| A. | 人工降雨 | B. | 植物的光合作用 | C. | 制化肥 | D. | 灭火 |
2.下列关于化学变化的说法正确的是( )
| A. | 凡是有发光、放热现象产生的变化一定是化学变化 | |
| B. | 物质在发生化学变化时,不一定发生物理变化 | |
| C. | 化学变化中一定伴随着放热、发光等现象 | |
| D. | 物质发生物理变化时,不一定发生化学变化 |
 (1)仔细观察图1后回答:该图反映的环境问题是工业的废气不达标排放,形成酸雨使植物死亡;请你提一条合理化建议工业废气达标排放.
(1)仔细观察图1后回答:该图反映的环境问题是工业的废气不达标排放,形成酸雨使植物死亡;请你提一条合理化建议工业废气达标排放.