题目内容
8.粗盐中含有难溶性杂质(泥沙等)和多种可溶性杂质(氯化镁、氯化钙等).某班同学在粗盐提纯实验中,为把少量可溶性杂质CaCl2,MgCl2一并除去,将教材中实验方案修改设计如下,请据此回答问题: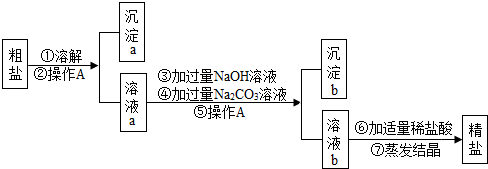
(1)实验操作A 中用到的玻璃容器是烧杯、漏斗和玻璃棒 操作A的目的是除去难溶性杂质.
(2)写出步骤③中发生反应的主要化学方程式MgCl2+2NaOH═Mg(OH)2↓+2NaCl,步骤⑥的作用是除去过量的氢氧化钠和碳酸钠.
(3)小刚同学认为该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多,请你为他找出理由:因为在实验过程中有氯化钠生成.
(4)工业上可用电解饱和氯化钠溶液的方法制得烧碱、氯气、氢气,请写出该反应的化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
分析 (1)根据过滤操作的仪器和实验目的解答;
(2)根据要求正确书写化学方程式,步骤⑥加适量稀盐酸的作用是除去过量的氢氧化钠和碳酸钠;
(3)根据实验过程中各步反应的生成物解答;
(4)根据反应原理来分析解答.
解答 解:(1)实验操作A的名称是过滤,用到的玻璃仪器有烧杯、漏斗和玻璃棒,其中的玻璃容器是烧杯;该操作的目的是除去难溶性杂质;
(2)实验步骤③的主要目的是除去氯化镁,氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,反应的化学方程式为:
MgCl2+2NaOH═Mg(OH)2↓+2NaCl.步骤⑥加适量稀盐酸的作用是除去过量的氢氧化钠和碳酸钠;
(3)因为在实验过程中有氯化钠生成,故该方案实际得到的氯化钠可能比粗盐中含有的氯化钠要多.
(4)饱和食盐水通电的方法可制得氢氧化钠、氯气和氢气,该反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
故答案为:(1)烧杯;除去难溶性杂质;
(2)MgCl2+2NaOH═Mg(OH)2↓+2NaCl,除去过量的氢氧化钠和碳酸钠;
(3)因为在实验过程中有氯化钠生成;
(4)2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑.
点评 本题涉及除杂、化学方程式的书写、等方面的知识,难度适中,是综合性题目.

练习册系列答案
相关题目
19.在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
(2)操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使溶液体受热均匀,防止液滴外溅
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH
乙:NaOH和Na2CO3的混合物
丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
【反思与评价】同学们认真研究实验流程,讨论后一致认为乙、丙两同学的方案、现象和推理均正确,请你根据实验流程对甲同学设计的方案进行合理的评价:因为碳酸钠、氢氧化钙的水溶液都显碱性,它们都能够使酚酞试液变红色,所以酚酞试液变红色,不能说明是纯净的氢氧化钠.

(1)贝壳高温煅烧时,发生反应的化学方程式是CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
(2)操作Ⅰ中用到的玻璃仪器有烧杯、漏斗、玻璃棒;
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是使溶液体受热均匀,防止液滴外溅
【问题与发现】该小组同学所得到固体C一定是纯净的NaOH吗?
【猜想与假设】根据反应原理,甲、乙、丙三位同学提出以下猜想:
甲:纯净的NaOH
乙:NaOH和Na2CO3的混合物
丙:NaOH和Ca(OH)2的混合物
【探究与验证】甲、乙、丙三位同学分别设计下列方案,对自己的猜想进行验证.实验操作、现象和结论如下表,请参与他们的探究并完成所缺内容.
| 实验操作 | 现象 | 结论 | |
| 甲 | 取少量固体C,溶于适量水形成溶液后,滴加几滴酚酞试液 | 溶液变红 | 猜想成立 |
| 乙 | 取少量固体C,溶于适量水形成溶液后,滴加足量稀盐酸 | 无气泡产生 | 猜想不成立 |
| 丙 | 取少量固体C,溶于适量水形成溶液后,滴加几滴饱和溶液碳酸钠溶液 | 生成白色沉淀 | 猜想成立 |
16.在下表栏目中,填写正确的名称、化学式、类别(是指“单质、氧化物、酸碱盐或有机化合物”和加点元素的化合价.
| 序号 | (1) | (2) | (3) | (4) | (5) |
| 名称 | 亚硫酸 | 氖气 | 碳酸氢铵 | 酒精 | |
| 化学式 | H2SO3 | Fe(OH)2 | NH4HCO3 | C2H5OH | |
| 类别 | |||||
| 化合价 | 0 | +2 | -2 |
3. 金属用途广泛,其结构、性质等是化学的重要研究内容.
金属用途广泛,其结构、性质等是化学的重要研究内容.
(1)如图1是铝的原子结构.下列说法不正确的是C
A.铝原子的质子数为13
B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图2实验,并对溶液A和固体B的成分进行了分析和研究.
【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
①只有Zn(NO3)2
②Zn(NO3)2、AgNO3
③Zn(NO3)2、Cu(NO3)2
④Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是② (填标号),其理由是猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,而铜能与硝酸银反应,所以不可能存在硝酸银.
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
(3)如图3是工业炼铁示意图.其中,焦炭的作用是燃烧提供能量和做还原剂.有铁生成的化学方程式为Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2.
 金属用途广泛,其结构、性质等是化学的重要研究内容.
金属用途广泛,其结构、性质等是化学的重要研究内容.(1)如图1是铝的原子结构.下列说法不正确的是C
A.铝原子的质子数为13
B.在化合物中铝通常显+3价
C.铝是地壳中含量最多的元素
D.铝可作导线是由于它具有良好的导电性
(2)某化学小组用一定量的AgNO3和Cu(NO3)2混合溶液进行了如图2实验,并对溶液A和固体B的成分进行了分析和研究.
【提出问题】溶液A中的溶质可能有哪些?
【做出猜想】
①只有Zn(NO3)2
②Zn(NO3)2、AgNO3
③Zn(NO3)2、Cu(NO3)2
④Zn(NO3)2、Cu(NO3)2、AgNO3
【交流讨论】不合理的猜想是② (填标号),其理由是猜想②中无硝酸铜,说明Cu(NO3)2 已与锌反应生成Cu,而铜能与硝酸银反应,所以不可能存在硝酸银.
【实验探究】若猜想①成立,通过以下实验可确定固体B的成分,请将下表填写完整.
| 实验步骤 | 现象 | 有关反应的化学方程式 |
| 取少量固体B,滴加稀盐酸 | 有气泡产生 | Zn+2HCl═ZnCl2+H2↑ |
20.下表中列举的是通常状况下除去混合物中所含杂质的方法其中正确的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CuSO4粉末 | Fe粉 | 加水充分搅拌;过滤;将滤液蒸发结晶 |
| B | C粉 | CuO粉末 | 加入过量稀盐酸.充分反应后,过滤,凉干 |
| C | CO2气体 | CO | 通入氧气,点燃 |
| D | MnO2 | KClO3 | 充分加热后.冷却 |
| A. | A | B. | B | C. | C | D. | D |
18.功能饮料可调节人体生理机能,补充营养素,按酸碱性可分为酸性与碱性两类.
①甲基橙是一种酸碱指示剂,下表为甲基橙在不同pH时的变色情况:
某无色饮料滴入甲基橙后变为橙色,则该饮料是A功能饮料(填序号).
A、酸性 B、碱性 C、中性 D、无法确定
②欲进一步测定上述饮料的酸碱度,可使用pH试纸.测定方法是用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比读出pH.
③某饮料含有下列元素,其中不属于人体必需微量元索的是B(填序号).
A、Fe B、Ca C、Zn D、Cu.
①甲基橙是一种酸碱指示剂,下表为甲基橙在不同pH时的变色情况:
| PH | <3.1 | 3.1~4.4 | >4.4 |
| 颜色 | 红色 | 橙色 | 黄色 |
A、酸性 B、碱性 C、中性 D、无法确定
②欲进一步测定上述饮料的酸碱度,可使用pH试纸.测定方法是用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比读出pH.
③某饮料含有下列元素,其中不属于人体必需微量元索的是B(填序号).
A、Fe B、Ca C、Zn D、Cu.


