题目内容
14.某学生设计了如图的实验方案来分离NaCl和CaCl2两种固体组成的混合物A: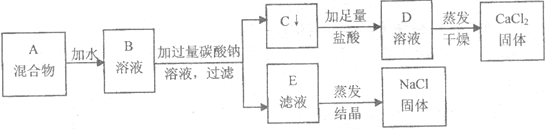
试回答:(1)C物质的化学式为CaCO3,D溶液中溶质的名称氯化钙.
(2)写出此方案中生成C的化学方程式:Na2CO3+CaCl2=CaCO3↓+2NaCl.
(3)玻璃棒在过滤中的作用是引流,在蒸发时却是搅拌防止局部过热,造成液滴飞溅.
(4)若用实验得到的CaCl2固体配制80g12%的CaCl2溶液,需要称9.6gCaCl2固体,配制过程中需要的主要玻璃仪器有烧杯、玻璃棒和量筒.
(5)实验得到的NaCl经分析发现含有杂质,此杂质是Na2CO3,为避免产生此杂质,你认为在此方案设计中应作的修改是向E溶液中加足量的稀盐酸,充分反应后再蒸发.
分析 (1)根据碳酸钙和氯化钙反应会生成碳酸钙沉淀和氯化钠,碳酸钙和盐酸反应会生成氯化钙、水和二氧化碳,经过蒸发、干燥可以得到氯化钙固体进行分析;
(2)根据碳酸钙和氯化钙反应会生成碳酸钙沉淀和氯化钠进行分析;
(3)根据玻璃棒在过滤中的作用是引流,在蒸发时是搅拌防止局部过热,造成液滴飞溅进行分析;
(4)根据溶质质量=溶液质量×溶质质量分数,配制溶液过程中需要的主要玻璃仪器有烧杯、玻璃棒和量筒进行分析;
(5)根据实验过程中加入过量的碳酸钠,碳酸钠会与盐酸反应生成氯化钠、水和二氧化碳进行分析.
解答 解:(1)碳酸钙和氯化钙反应会生成碳酸钙沉淀和氯化钠,所以C物质的化学式为CaCO3,碳酸钙和盐酸反应会生成氯化钙、水和二氧化碳,经过蒸发、干燥可以得到氯化钙固体,所以D溶液中溶质的名称氯化钙;
(2)碳酸钙和氯化钙反应会生成碳酸钙沉淀和氯化钠,化学方程式为:Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)玻璃棒在过滤中的作用是引流,在蒸发时是搅拌防止局部过热,造成液滴飞溅;
(4)需要氯化钙质量为:80g×12%=9.6g,配制溶液过程中需要的主要玻璃仪器有烧杯、玻璃棒和量筒;
(5)将此实验方法分离得到的NaCl,一定会含有杂质,原因是前面加入的碳酸钠过量没有除去,正确的设计方案应该是滤液蒸发结晶之前加盐酸,至不再产生气体为止,从而消耗掉过量的碳酸钠,得到纯净的氯化钠.
故答案为:(1)CaCO3,氯化钙;
(2)Na2CO3+CaCl2=CaCO3↓+2NaCl;
(3)引流,防止局部过热,造成液滴飞溅;
(4)9.6g,量筒;
(5)Na2CO3,向E溶液中加足量的稀盐酸,充分反应后再蒸发.
点评 本题是一道考查固固混合物分离的方法,除杂题是初中化学常见题型,它灵活多变,可以综合考查学生的解题能力.混合物分离或提纯方法综合可以分为两大类:一类是物理方法(如过滤和结晶等),一类是化学方法(如沉淀法,气体法,置换法和吸收法等).

| A. | 食盐和白糖 | B. | 食盐和泥沙 | C. | 铁粉和铜粉 | D. | 二氧化碳和氧气 |
| A. | 2N表示两个氮分子 | B. | 硫离子的符号为S2- | ||
| C. | 一氧化碳的化学式是Co | D. | H2O中含有氧分子 |
| A. |  射阳河银鱼 | B. |  射阳大米 射阳大米 | C. |  龙冈茌梨 | D. |  东沟茶干 东沟茶干 |
| A. | 元素的化学性质 | B. | 元素的种类 | C. | 元素的核电荷数 | D. | 原子的质量 |

 构建知识网络是学习化学的重要方法之一,李明在学习酸、碱、盐后归纳并绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白:
构建知识网络是学习化学的重要方法之一,李明在学习酸、碱、盐后归纳并绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白: