题目内容
19. 构建知识网络是学习化学的重要方法之一,李明在学习酸、碱、盐后归纳并绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白:
构建知识网络是学习化学的重要方法之一,李明在学习酸、碱、盐后归纳并绘制出如图所示的物质之间的反应关系,(图中短线连接的物质表示能相互反应),请填写下列空白:(1)在图中空白方框中可填写指示剂或氧化物(填物质类别).
(2)反应⑦要能发生要求金属必须排在金属活动性表H或氢的前面.
(3)图中所归纳出酸的化学性质共有5条.
(4)写出一个符合反应④的方程式CaCO3+2HCl=CaCl2+H2O+CO2↑.
(5)验证反应①,可以选择下列AC(两种物质序号)进行反应
A.Na2SO4 B.KNO3 C.Ba(OH)2 D.NaOH
(6)碱具有相似的化学性质的原因是,碱溶液中都含有OH-(填微粒符号).
分析 (1)据酸与碱都可与氧化物、紫色石蕊试液反应分析;
(2)根据位于氢前的金属可与酸反应放出氢气分析;
(3)根据酸的化学性质分析;
(4)根据酸与盐反应的规律写化学方程式;
(5)根据碱与盐反应的条件是生成物之一必为沉淀分析;
(6)碱具有相似的化学性质是因为碱溶液中都含有OH-.
解答 解:(1)酸可与金属氧化物反应,碱可与非金属氧化物反应,酸和碱都可与紫色石蕊试液反应,故图中空白方框中可填写紫色石蕊或氧化物;
(2)位于氢前的金属可与酸反应放出氢气,故对金属的要求是该金属必须位于金属活动性顺序氢的前面;
(3)通过分析可知酸的化学性质有5条,分别是酸与指示剂、金属、金属氧化物、碱、盐反应;
(4)由图可知,反应④是盐和酸的反应,据复分解反应发生的条件可以写化学方程式:CaCO3+2HCl═CaCl2+H2O+CO2↑;
(5)由图可知,反应①是碱和盐的反应,碱和盐的反应属于复分解反应,故生成物必有沉淀,反应才可进行,盐Na2SO4碱Ba(OH)2反应可生成硫酸钡沉淀,符合条件;
(6)碱具有相似的化学性质是因为碱溶液中都含有 OH-.
故答案为:(1)氧化物;(2)H或氢;(3)5;(4)CaCO3+2HCl=CaCl2+H2O+CO2↑;(5)A、C; (6)OH-.
点评 本题考查了常见酸、碱、盐等物质的化学性质及复分解反应发生的实质,在解此类题时,首先要充分识图,然后根据复分解反应的原理进行分析反应物具有的特征,最后再书写方程式和规律.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.不少家庭养观赏鱼,有时会在鱼缸里放点“鱼浮灵”,可使水中的含氧量迅速增加,“鱼浮灵”的俗称固体双氧水,放入水中缓慢放出氧气,某研究小组以过氧化氢反应的快慢来探究影响化学反应快慢的一些因素的相关数据(常温通常指20℃,“浓度”指溶质的质量分数)
(1)通过实验①和②对比可知,化学反应快慢与过氧化氢溶液的浓度有关;
(2)通过对比实验③和④可知,化学反应快慢与温度的关系是在其他条件相同时,温度越高,反应越快.
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是20℃时,5%过氧化氢溶液中加入少量二氧化锰.
(4)实验室用过氧化氢制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
| 实验 序号 | 过氧化氢溶液浓度% | 过氧化氢溶液质量/g | 温度/℃ | 二氧化锰用量/g | 氧气体积/ml | 反应所需时间/s |
| ① | 5 | 12 | 20 | 0.2 | 125 | 11 |
| ② | 30 | 12 | 20 | 0.2 | 125 | 2 |
| ③ | 30 | 12 | 40 | / | 125 | 148 |
| ④ | 30 | 12 | 90 | / | 125 | 82 |
(2)通过对比实验③和④可知,化学反应快慢与温度的关系是在其他条件相同时,温度越高,反应越快.
(3)由上述实验可知,实验室用过氧化氢制取氧气的最合适的条件是20℃时,5%过氧化氢溶液中加入少量二氧化锰.
(4)实验室用过氧化氢制取氧气的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
4.下列说法中正确的是( )
| A. | 同种元素组成的物质一定是单质 | B. | 原子是化学反应中的最小粒子 | ||
| C. | 含有氧元素的化合物称为氧化物 | D. | 分子可分而原子不可分 |
9.4gA物质与7gB物质混合反应能生成6gC物质,若将7gA与3gB混合反应能生成C物质的质量是( )
| A. | 3g | B. | 10g | C. | 8g | D. | 9g |


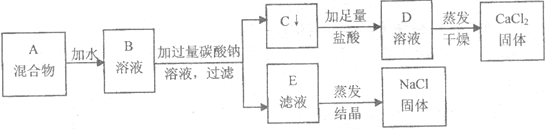
 纯碱、烧碱、氯化钠在一定条件下可以发生如图所示的转化关系.
纯碱、烧碱、氯化钠在一定条件下可以发生如图所示的转化关系.