题目内容
19.向NaHCO3溶液中逐滴加入稀硫酸至无气泡产生时,消耗稀硫酸20g,产生气体4.4g,称量反应后溶液总质量为115.6g.(2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑)计算:(1)NaHCO3中钠元素与氧元素的质量比为23:48.
(2)所用NaHCO3溶液中溶质的质量分数.(写出计算过程)
(3)已知实验室中常用3%~5%的NaHCO3溶液来进行浓硫酸的事故处理,若用(2)中溶液(溶液质量、质量分数皆不变)来配制4.2%的NaHCO3溶液以备不时之需,需要向溶液中加100g(填“H2O”或“NaHCO3”)才符合要求.
分析 (1)根据化合物中元素质量比的计算方法来分析;
(2)由二氧化碳的质量根据反应的化学方程式计算出碳酸氢钠、
(3)根据题意,溶液稀释前后,溶质质量不变解答.
解答 解:
(1)碳酸氢钠中钠元素与氧元素的质量比是23:(16×3)=23:48;
(2)设溶液中NaHCO3质量为x.二氧化碳的质量为4.4g
2NaHCO3+H2SO4═Na2SO4+H2O+2CO2↑
168 88
x 4.4g
$\frac{168}{x}=\frac{88}{4.4g}$
x=8.4g
NaHCO3溶液的质量=115.6g+4.4g-20g=100g
所用NaHCO3溶液中溶质的质量分数=$\frac{8.4g}{100g}×$100%=8.4%;
(3)由100g8.4%的NaHCO3溶液配制4.2%的NaHCO3溶液,需要向溶液中加水的质量为y
100g×8.4%=(100g+y)×4.2%
y=100g
答案:
(1)23:48;
(2)所用NaHCO3溶液中溶质的质量分数为8.4%;
(3)100
点评 本题难度不大,掌握根据化学方程式与溶质质量分数的综合计算即可正确解答本题.

练习册系列答案
相关题目
7.学习化学以后,我们对水有了更全面的认识,下列说法正确的是( )
| A. | 电解水时在负极得到氧气 | |
| B. | 少量植物油滴入水中,形成植物油的水溶液 | |
| C. | 水的蒸馏过程中分子种类不变 | |
| D. | 过滤能使硬水转化为软水 |
4. 如图是元素周期表的两种元素的信息,下列说法中正确的是( )
如图是元素周期表的两种元素的信息,下列说法中正确的是( )
 如图是元素周期表的两种元素的信息,下列说法中正确的是( )
如图是元素周期表的两种元素的信息,下列说法中正确的是( )| A. | 两种元素都是非金属元素 | |
| B. | 一个金属原子质量比一个氟原子质量小 | |
| C. | 金原子的中子数为197 | |
| D. | 氟原子的核外电子数为9 |
8.某校学生调查发现,位于歌乐山的甲、乙两工厂排放的污水各含下列离子H+、Fe3+、K+、NO3-、OH-中的三种离子(两厂含有一种相同的离子).若将两厂的污水按一定比例混合,沉淀后污水会变成无色澄清的中性溶液.下列来自同一工厂的离子组合正确的是( )
| A. | OH-和Fe3+ | B. | H+和OH- | C. | Fe3+和K+ | D. | H+和Fe3+ |

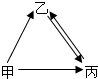 如图中甲、乙、丙均为初中化学常见的物质,已知它们均含有地壳中含量最多的元素,它们之间有如图所示的转化关系,丙是单质;甲、乙通常为液体,请按要求填写下列空白:
如图中甲、乙、丙均为初中化学常见的物质,已知它们均含有地壳中含量最多的元素,它们之间有如图所示的转化关系,丙是单质;甲、乙通常为液体,请按要求填写下列空白: