题目内容
8.某校学生调查发现,位于歌乐山的甲、乙两工厂排放的污水各含下列离子H+、Fe3+、K+、NO3-、OH-中的三种离子(两厂含有一种相同的离子).若将两厂的污水按一定比例混合,沉淀后污水会变成无色澄清的中性溶液.下列来自同一工厂的离子组合正确的是( )| A. | OH-和Fe3+ | B. | H+和OH- | C. | Fe3+和K+ | D. | H+和Fe3+ |
分析 根据复分解反应的条件,离子间若能互相结合成沉淀、气体或水,则离子不能共存,即不能共存的离子不能存在于同一工厂的废水中.
解答 解:假设氢离子来自甲厂,则能与氢离子结合生成水分子的氢氧根离子得来自乙厂,能与氢氧根离子结合生成氢氧化铁沉淀的铁离子得来自甲厂,分析给出的五种离子,确定甲厂的离子有氢离子、铁离子和硝酸根离子,乙厂的离子有钾离子、硝酸根离子和氢氧根离子,分析选项,故选D.
点评 本题考查了物质能否共存的问题,完成此类题目,可以依据复分解反应的条件进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.关于CO和CO2的说法错误的是( )
| A. | CO2可用于光合作用、灭火、人工降雨等 | |
| B. | CO能燃烧,具有毒性和还原性 | |
| C. | CO和CO2性质和用途的差异较大,是因为组成它们的元素的种类不同 | |
| D. | CO2不供给呼吸的性质和CO的毒性都会致人死亡 |
13.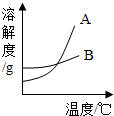 运用溶解度表与溶解度曲线图回答下列问题:
运用溶解度表与溶解度曲线图回答下列问题:
(1)图中表示氯化钠溶解度曲线的是B(填字母序号).
(2)在溶解度曲线图中找出表示A、B两种物质在某温度下溶解度相等的点,用P点标注在图上,并注明此时的温度和溶解度数值.
(3)40℃时,100g水中加入40gA物质,所得溶液是不饱和(填“饱和”或“不饱和”)溶液.
(4)生活在盐湖边的人们习惯“冬捞碱,夏晒盐”,请解释“冬捞碱”的原理是碳酸钠的溶解度受温度影响大,冬天温度低,碳酸钠溶解度变小,易结晶析出.
 运用溶解度表与溶解度曲线图回答下列问题:
运用溶解度表与溶解度曲线图回答下列问题:| 温度/°C | 0 | 10 | 20 | 30 | 40 | |
| 溶解度/g | 氯化钠 | 35 | 35.5 | 36 | 36.5 | 37 |
| 碳酸钠 | 6 | 10 | 18 | 36.5 | 50 | |
(2)在溶解度曲线图中找出表示A、B两种物质在某温度下溶解度相等的点,用P点标注在图上,并注明此时的温度和溶解度数值.
(3)40℃时,100g水中加入40gA物质,所得溶液是不饱和(填“饱和”或“不饱和”)溶液.
(4)生活在盐湖边的人们习惯“冬捞碱,夏晒盐”,请解释“冬捞碱”的原理是碳酸钠的溶解度受温度影响大,冬天温度低,碳酸钠溶解度变小,易结晶析出.
20. 在以下的“四连环”图中,每环代表一种物质,相连环间所代表的物质在一定条件下可以发生反应,下表的选项中,符合这一要求的是( )
在以下的“四连环”图中,每环代表一种物质,相连环间所代表的物质在一定条件下可以发生反应,下表的选项中,符合这一要求的是( )
 在以下的“四连环”图中,每环代表一种物质,相连环间所代表的物质在一定条件下可以发生反应,下表的选项中,符合这一要求的是( )
在以下的“四连环”图中,每环代表一种物质,相连环间所代表的物质在一定条件下可以发生反应,下表的选项中,符合这一要求的是( )| A | B | C | D | |
| 甲 | Zn | H2SO4 | CO | O2 |
| 乙 | HCl | NaOH | O2 | C |
| 丙 | CuO | CuSO4 | Fe2O3 | CO |
| 丁 | Cu | Mg | C | CO2 |
| A. | A | B. | B | C. | C | D. | D |
 已知A、B为两种黑色粉末,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.
已知A、B为两种黑色粉末,D为红色单质.A、B、C、D、E五种物质之间的转化关系如图所示.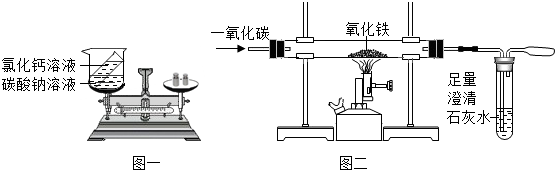
 已知某元素的原子结构示意图如图,该原子的质子数是19,该元素属于金属元素(填金属元素或非金属元素),在化学变化中容易失去一个电子,成为钾离子.
已知某元素的原子结构示意图如图,该原子的质子数是19,该元素属于金属元素(填金属元素或非金属元素),在化学变化中容易失去一个电子,成为钾离子.
